
CD40激动性单抗+PD-1+化疗方案疗效未达预期,IO-IO拮抗或是原因
Sotigalimab(APX005M)是一种在研的新型CD40激动性单克隆抗体,通过激动CD40增强抗肿瘤免疫应答,在多种实体瘤临床前研究中,Sotigalimab联合其它治疗体现了更好的效应。此前一项临床Ib期研究显示,Sotigalimab联合吉西他滨+白蛋白紫杉醇±纳武利尤单抗,对转移性胰腺导管腺癌(PDAC)初治患者有临床活性,24例可评价疗效患者的客观缓解率(ORR)为58%,推荐用于II期研究的Sotigalimab剂量为0.3mg/kg[1]。
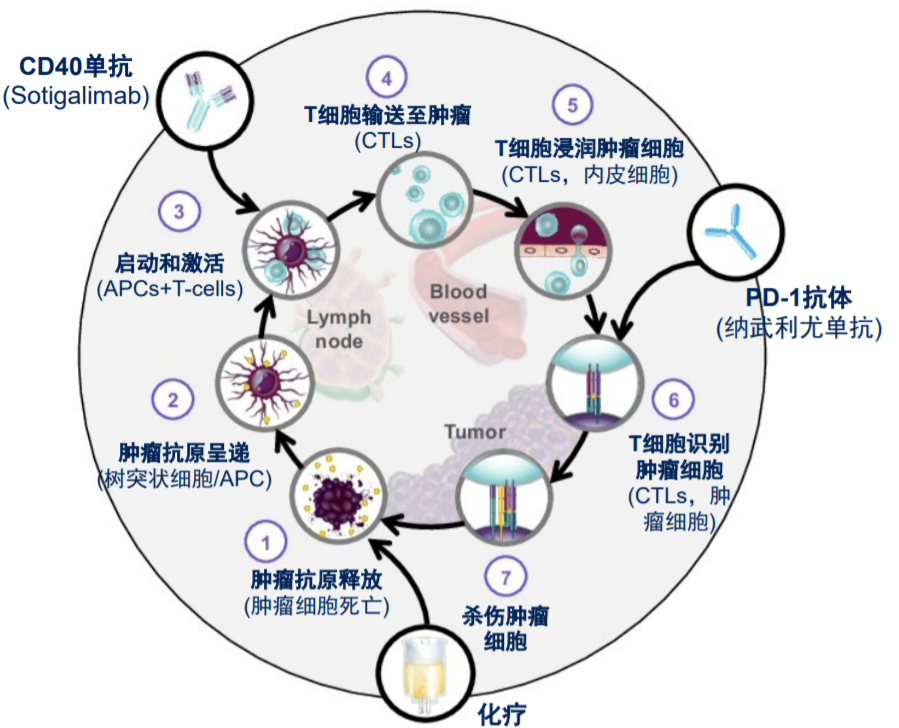
图1、Sotigalimab+化疗±纳武利尤单抗可能的作用机制
本届ASCO年会上报告了Sotigalimab联合吉西他滨+白蛋白紫杉醇±纳武利尤单抗方案,用于转移性PDAC患者一线治疗的临床II期研究最终结果,该研究在此前Ib期研究的基础上进一步扩大规模,安全性人群共有108例患者,105例患者被纳入疗效分析,且本次数据统计时(2021年3月)所有受试者随访时间均长于15个月,研究设计如图2所示。
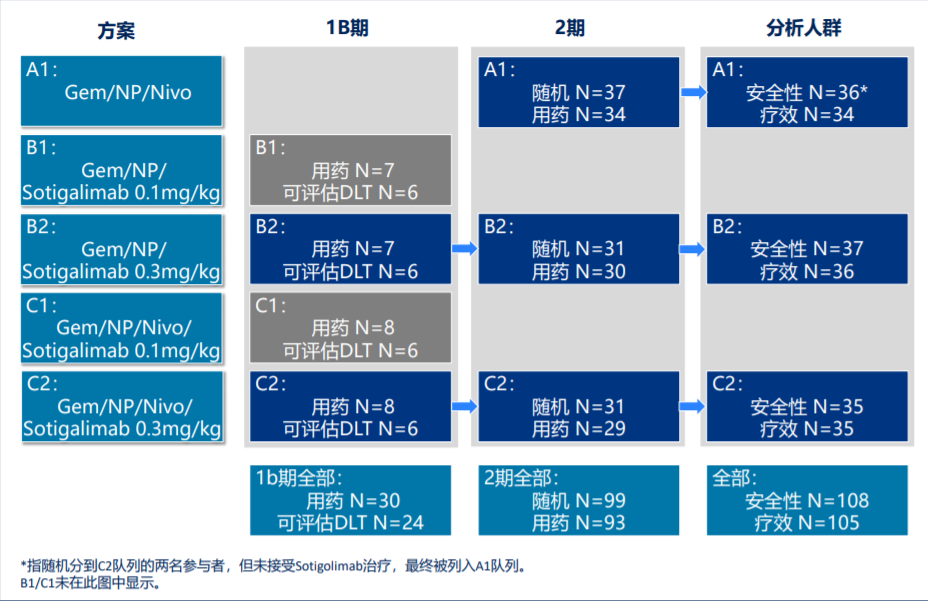
图2、研究整体设计
II期研究的主要终点为各组患者1年总生存率,与单纯化疗的历史生存率数据(35%)对比,次要终点包括治疗安全性、ORR、疾病控制率(DCR)、无进展生存期(PFS)、缓解持续时间(DoR)等,并设置免疫药效学和生物标志物的探索性终点。患者整体基线特征如表1所示,各组间患者基线特征平衡,肿瘤基因表达、肿瘤免疫情况、免疫特征和肠道微生物富集程度等肿瘤基线特征和免疫分析也基本平衡,与此前已发表的PDAC相应数据一致。
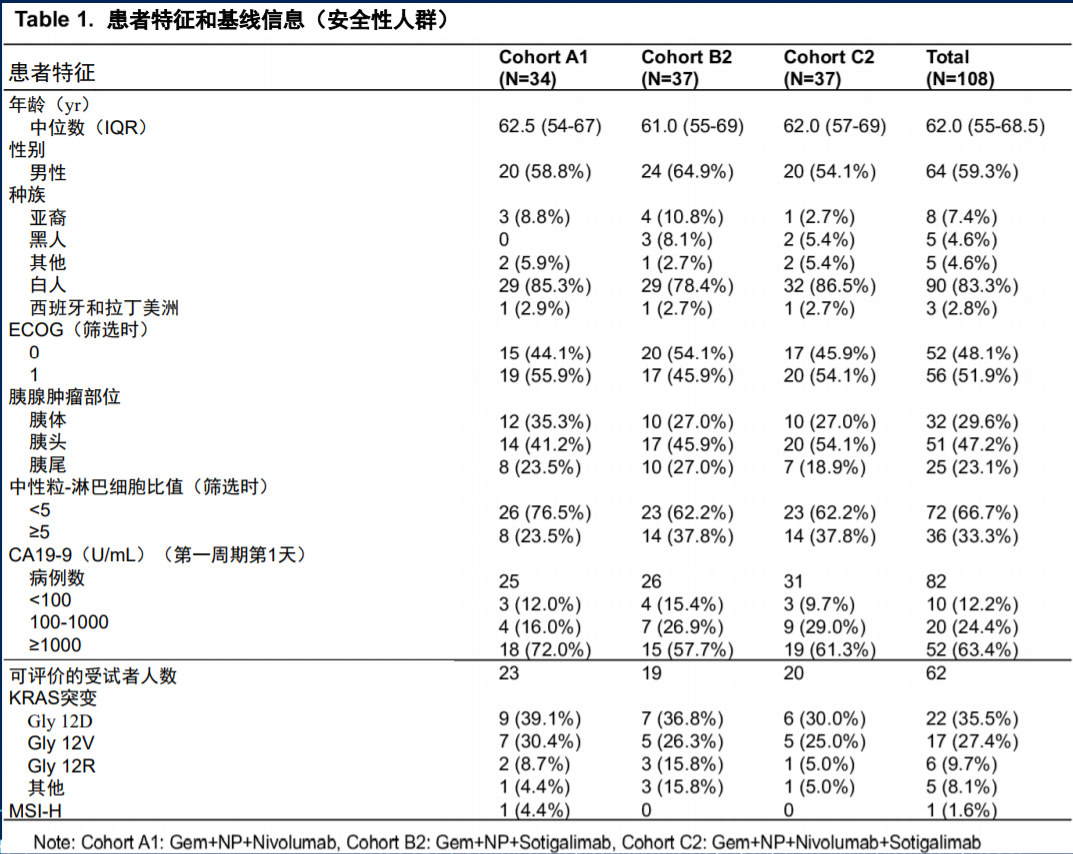
表1 患者特征和基线信息
疗效数据显示,A1、B2和C2队列的1年OS率分别为57.3%(与历史生存率35%对比,单侧p=0.007,下同)、48.1%(单侧p=0.062)和41.3%(单侧p=0.236),因此仅有队列A1即纳武利尤单抗+化疗方案达到预设的主要终点。总生存曲线、靶病灶总和的百分比变化,次要终点的各项疗效指标数据见图3。
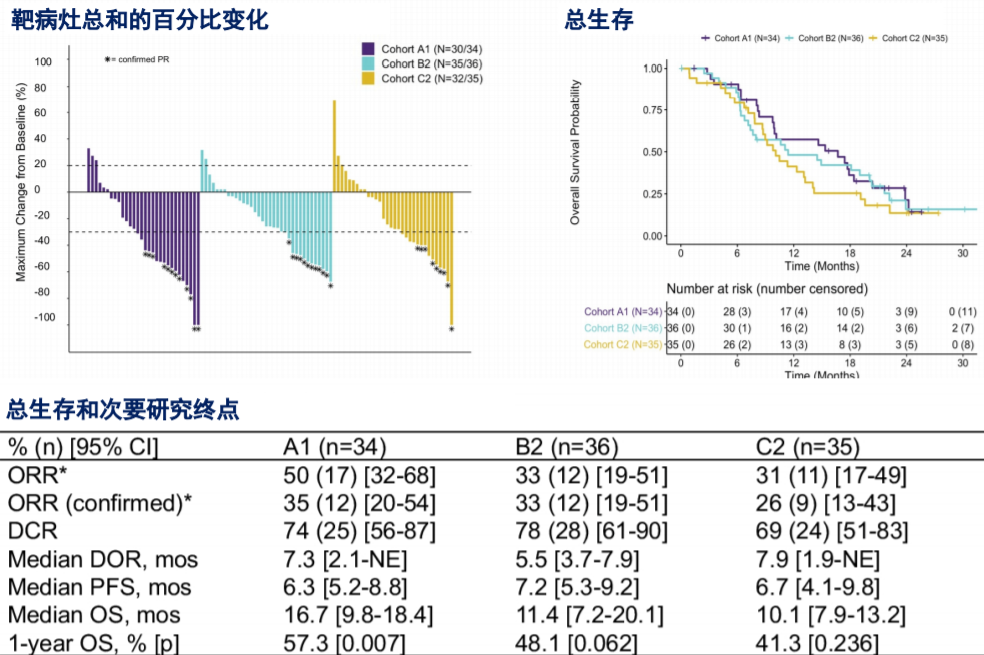
图3、疗效数据汇总
安全性方面的数据显示,98.1%的受试者出现治疗相关不良反应(TRAE),各组间发生率大致相同,发生率≥10%且排在前五的TRAEs见表2。8例(7%)受试者因不良事件停药,其中A1组6例(外周血粒细胞减少、心肌炎、肺炎、微动脉造影栓塞(2)、高胆红素血症),B2组1例(肺炎),C2组1例(高热)。
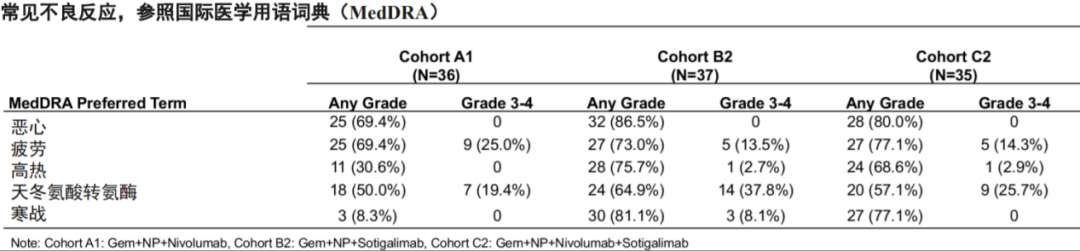
表2、治疗相关不良反应汇总
39例(36%)受试者出现严重TRAE(A1,B2和C2组分别有13、15、11例),其中2例受试者因TRAEs死亡:B2组1例(急性肝功能衰竭,可能与所有研究药物均相关),C2组1例(颅内出血,可能与所有研究药物均相关);细胞因子释放综合征在A1,B2和C2组中分别有0、9例(24.3%)和12例(34.3%),3-4级的分别为0、3例和2例。
药效学作用数据显示,A1、B2和C2组治疗方案均增加了患者的活化效应记忆性(EM)T细胞数量,其中队列A1的化疗+纳武利尤单抗作用最强,B2和C2队列中大多数患者活化髓样树突状细胞(CD86+mDC)数量增加,为Sotigalimab预期的药效学作用,且Sotigalimab+化疗(队列B2)中CD80+ M1巨噬细胞数量增加;而队列A1中CD86+mDC数量有所减少,表达PD-L1的肿瘤细胞比例减少,具体如图4所示。
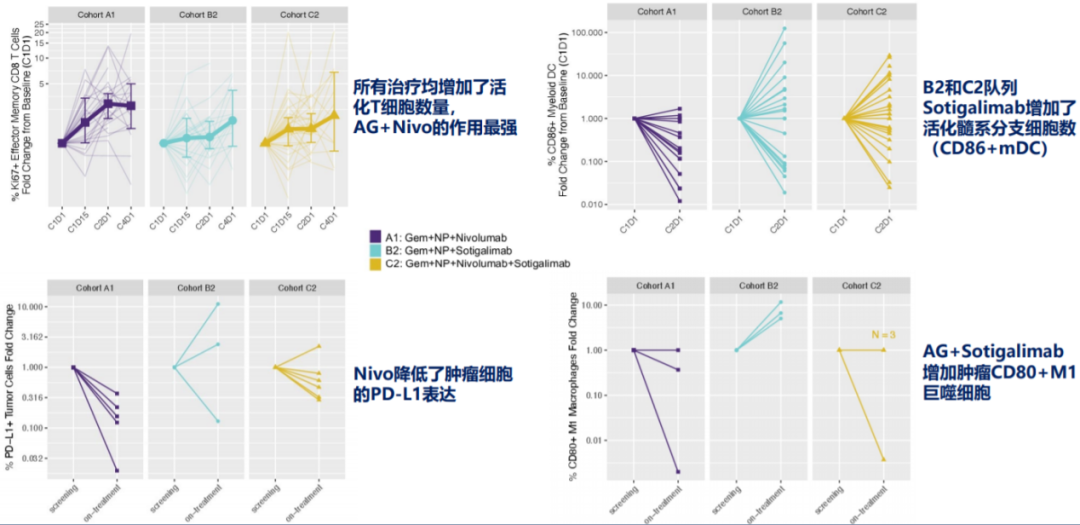
图4、研究的药效学作用数据
生物标志物分析显示,基线较高的CXCR5+效应记忆CD4+T细胞水平,与A1队列的生存改善相关,与B2队列的较短生存相关;基线较低的CD244+效应记忆CD4+T细胞水平,与B2队列的生存改善相关,但与A1、C2队列生存结局无关;基线较低的TNF-α水平,与A1队列的生存改善相关,但与B2、C2队列生存结局无关;基线较低的MYC基因信号,与B2队列的生存改善相关,但与A1、C2队列生存结局无关,具体如图5所示。
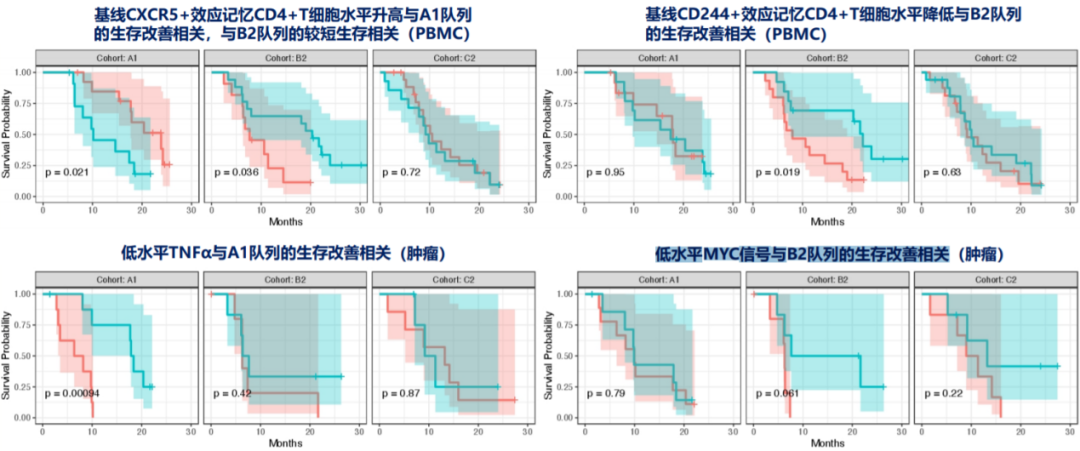
图5、生物标志物相关探索性分析
综上所述,这一II期研究中仅有纳武利尤单抗+化疗方案达到预设主要终点,而Sotigalimab+化疗方案(队列B2)抗肿瘤活性一般,治疗整体的安全性可控,但没有明确的生物标志物亚组显示出获益。基于Sotigalimab+化疗+纳武利尤单抗组(队列C2)患者的药效学效应,研究者假设该方案或存在IO-IO药物拮抗。未来有必要对基线生物标志物进一步探索并进行前瞻性检测,以提高PDAC中IO+化疗的临床精准治疗[2]。
长期随访数据证实,术前新辅助放化疗可改善可手术胰腺癌患者的生存
本届ASCO年会还更新了荷兰多中心、前瞻性临床III期PREOPANC研究的长期生存数据,该研究共入组246例可切除或临界可切除(borderline resectable)的胰腺癌患者,随机分配到术前新辅助放化疗(3周期1000mg/㎡吉西他滨+15*2.4Gy放疗)+手术+吉西他滨术后辅助治疗(4个周期)组,或立即手术+吉西他滨辅助治疗,主要研究终点为意向治疗人群(ITT)的中位OS,次要终点包括手术切除率、R0切除率、治疗毒性等。
两组患者基线特征可比,可切除/临界可切除的比例均接近55%:45%,完成手术和切除比例、R0切除率等指标如表3所示,新辅助放化疗组患者的R0切除、N0切除率显著更高。

表3、两组患者外科结局
在中位时间56个月的随访后,ITT人群的OS数据如图6所示,新辅助放化疗组中位OS为15.7个月,显著优于立刻手术组的14.3个月(HR=0.73, 95% CI: 0.56-0.95, p=0.025),两组3年生存率分别为27.7%和16.5%,5年生存率分别为20.5%和6.5%,且无病生存期(DFS HR=0.70, p=0.009)、无局部治疗失败生存期(LFFI HR=0.57, p=0.004)和无远处转移生存期(DMFI HR=0.74, p=0.071)均提示新辅助放化疗可改善患者临床结局。
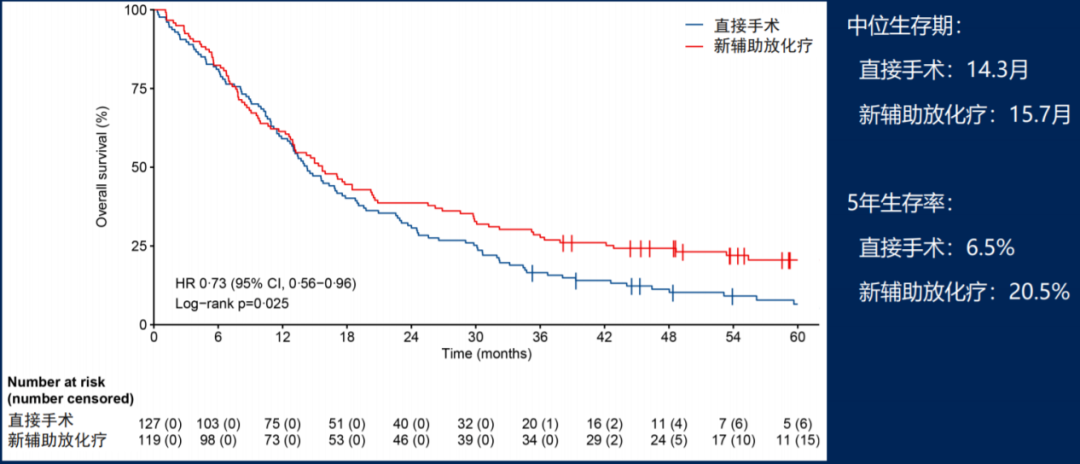
图6、ITT人群的OS分析
在完成肿瘤切除的164例患者(立刻手术组92例、新辅助放化疗组72例)中,新辅助放化疗组中位OS为33.7个月,较立即手术进一步改善患者长期生存,具体数据如图7所示,两组中可接受辅助治疗患者的OS对比也基本一致(mOS 35.4m vs. 19.8m, HR=0.52)。
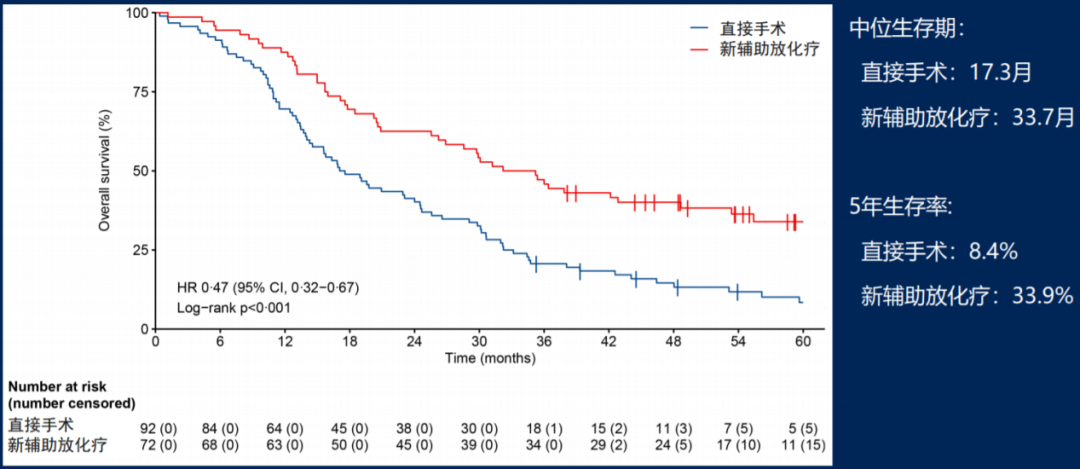
图7、接受肿瘤切除患者的生存分析
以上长期生存数据显示,对可切除或边界可切除患者,术前新辅助放化疗可较立即手术显著改善OS,尤其是新辅助放化疗后可顺利切除肿瘤的患者,5年生存率可超过30%[3]。PREOPANC研究是首个证实胰腺癌新辅助放化疗获益的多中心、随机对照、前瞻性III期研究[4],这一疗效数据有助于推广新辅助放化疗的临床应用。
北京大学肿瘤医院肝胆胰外二科暨腹膜后肿瘤中心副主任医师
2013年于英国卡迪夫大学医学院(Cardiff University School of Medicine)进修胰腺癌治疗
CSCO胰腺癌专家委员会委员兼秘书长
中国医疗保健国际交流促进会软组织肿瘤分会青年委员会常委
中国医疗保健国际交流促进会肝脏肿瘤分会青年委员会委员
“中华消化外科菁英荟”胰腺肿瘤分会委员
中国抗癌协会胃肠间质瘤专业委员会委员
北京大学肿瘤医院伦理委员会委员
《中华消化外科杂志》特邀审稿专家
《肝癌电子杂志》编委会青年编委
参考文献:
1. O’Hara M H, O’Reilly E M, Varadhachary G, et al. CD40 agonistic monoclonal antibody APX005M (sotigalimab) and chemotherapy, with or without nivolumab, for the treatment of metastatic pancreatic adenocarcinoma: an open-label, multicentre, phase 1b study[J]. The Lancet Oncology, 2021, 22(1): 118-131.
2. O’hara M H, O’reilly E M, Wolff R A, et al. Gemcitabine (Gem) and nab-paclitaxel (NP) ± nivolumab (nivo) ± CD40 agonistic monoclonal antibody APX005M (sotigalimab), in patients (Pts) with untreated metastatic pancreatic adenocarcinoma (mPDAC): Phase (Ph) 2 final results[J]. Journal of Clinical Oncology, 2021, 39(15_suppl): 4019.
3. Van Eijck C H J, Versteijne E, Suker M, et al. Preoperative chemoradiotherapy to improve overall survival in pancreatic cancer: Long-term results of the multicenter randomized phase III PREOPANC trial[J]. Journal of Clinical Oncology, 2021, 39(15_suppl): 4016.
4. Versteijne E, Suker M, Groothuis K, et al. Preoperative chemoradiotherapy versus immediate surgery for resectable and borderline resectable pancreatic cancer: results of the Dutch randomized phase III PREOPANC trial[J]. Journal of Clinical Oncology, 2020, 38(16): 1763-1773.
?





 京公网安备 11010502033352号
京公网安备 11010502033352号