关键点
- 亚洲地区和国家之间前列腺癌的流行病学和基因组特征有很大差异,基因组数据很少。
- 亚洲的前列腺癌发病率仍在增加;然而,从2007年到2016年,日本和以色列等高度发达国家的死亡率有所下降,但泰国、吉尔吉斯斯坦和乌兹别克斯坦等发展中国家的死亡率有所上升。
- 筛查在亚洲国家并不常见,但来自日本的证据显示,筛查的发病率从2000年的21.3%降低到2014年的11.6%,并且与生存率的提高有关。
- 东亚男性ERG癌蛋白阳性前列腺癌发病率较低(13-22%),而FOXA1在中国局限性前列腺癌患者中发生突变的频率(41%)高于白人患者。
- 遗传学研究表明,东亚和欧洲血统的前列腺癌患者的基因多态性非常不同,在这些人群中,DNA损伤修复基因的种系突变率相当(12%)。
- 睾酮代谢相关基因的药基因组研究显示,东亚男性与美国和欧洲白人民众之间睾酮代谢的内在差异,为雄激素剥夺治疗疗效的差异提供了潜在的解释。
前列腺癌是世界性的健康疾病,但是不同大陆的发病率差异很大。传统认为亚洲是低发病率的地区,但是亚洲地区的前列腺癌发病率和死亡率正迅速增高。在亚洲不同地区,流行病学上的特点有显著差异,并且发病率与死亡率和人类发展指数相关。2007年至2016年,日本和以色列的前列腺癌死亡率降低,但是在同时期,泰国、吉尔吉斯斯坦和乌兹别克斯坦的死亡率却上升。基因组分析表明,东亚人群中ERG癌蛋白患病率低,同时PTEN损失率低、CHD1富集度高、FOXA1突变率高。单核苷酸多态性对前列腺癌风险的贡献因种族而异,但在来自美国和英国的中国和白人患者中,转移性前列腺癌中DNA损伤修复基因的种系突变率是可比较的。睾酮代谢的药物原基因学特征可能导致东亚男性与美国和欧洲白人男性对雄激素剥夺的反应出现差异。总的来说,亚洲前列腺癌的流行病学和基因组学的大量多样性决定了这些人群的疾病特征,但在这一领域的研究文献不具有代表性。考虑到这种洲内和跨洲的不均匀性(异质性),为了发展种族特定治疗策略,进行转化性研究很有必要。
前列腺癌是全球男性第二最常见的诊断癌症以及导致癌症死亡的第六大主要原因;据估计,2020年全球共发生了大约1414259例前列腺癌新病例和375304例相关死亡病例。前列腺癌的发病率有显著的地理差异,传统上亚洲发病率最低。然而,随着经济的发展、预期寿命的延长和生活方式的西方化发展,前列腺癌的发病率正在迅速上升。2020年,前列腺癌是47个亚洲国家中20个国家男性最流行的三大癌症之一,并且是以色列、黎巴嫩、科威特、阿拉伯联合酋长国、卡塔尔、阿曼和日本最流行的癌症。这个趋势与发病率平缓或者下降的西方国家相反。
雄激素受体(AR)是前列腺癌进展的一个重要驱动因素,并且AR信号的抑制是传统上前列腺癌主要的治疗目标之一。基因组测序的进展已经揭示了除AR以外的可操作的前列腺癌靶点,包括聚Poly(ADP-核糖)聚合酶和程序细胞死亡蛋白1(PD1),前者是用于DNA修复异常的PARP抑制剂的靶点,后者可用于不匹配修复缺陷的阻断。这一快速发展的精准医学领域促使使用基因组方法进行患者分层和选择的需求,以实现个性化的治疗。但是,对亚洲人群前列腺癌的研究重视程度仍旧很低,并且大多数已经发表的来自基因组研究和临床试验的证据都集中在西方人群中,尽管存在公认的种族差异。数据的缺乏是为亚洲男性开发特定诊断和治疗方法的一个主要缺点。
在本综述中,我们对亚洲前列腺癌的流行病学和基因组学进行了全面的讨论,并考虑如何解决这些挑战来改善这些人群的患者护理。虽然亚洲人口并不均匀,但本综述主要集中于东亚男性的数据,因为在这些人口中有研究和遗传和/或文化背景的相似性。
在本地区和与世界其他地区比较中,对亚洲前列腺癌可研究的关于发病率、死亡率和生存率的数据进行检查和比较显示了一个有趣的趋势。此外,考虑亚洲不同国家的前列腺癌流行病学可以提高我们对疾病如何受到各种风险因素影响的理解,并强调了亚洲不同国家地区改善医疗保健的必要性。
前列腺癌的发病率和死亡率因全球各地的地理区域而异。作为世界上最大的大陆,亚洲占世界人口的近60.4%。然而,根据GLOBOCAN 2020年的估计,2020年亚洲的前列腺癌新发病例和死亡病例仅占全球的26.2%和32.1%。2020年,亚洲前列腺癌发病率的年龄标准化率(ASR)为每10万男性中有11.5人,为全球发病率最高的北美大陆(每10万人中有73人)的六分之一。相比之下,与发病率相比,前列腺癌死亡率的差异较小:亚洲前列腺癌死亡率的ASR为每10万人中有4.4人,约为全球死亡率最高的非洲(每10万人中有16.3人)的四分之一。死亡率与发病率的比率(MIR)是评估生存率和早期诊断的次要指标。因此,亚洲的MIR(0.38)比北美(0.11)高出三倍左右。相应的,北美大陆5年的前列腺癌患病率是亚洲的10倍,分别为每10万男性中有509.3人和49.6人。
亚洲各地区间的前列腺癌发病率差异高达5倍,西亚最高,中南亚最低(表1)。西亚前列腺癌死亡率的发病率也最高,约是亚洲其他地区的1.6-2.7倍。从2015年到2020年,东亚的5年前列腺癌患病率约占全球的16.5%,尽管每个男性人口的比例仅占北美的五分之一。2020年,亚洲地区的MIR从0.27到0.49,而全球的MIR是0.25。亚洲MIR最高的是中南亚(0.49),是东亚的两倍(0.27),是北美的4倍(0.11)。这些变化描述了前列腺癌在亚洲亚区域之间的变化带来的挑战。例如,由于该地区人口众多(占世界男性人口的22%)和老龄化社会(2019年12.9%的东亚人口年龄为≥65岁),2020年,东亚新诊断前列腺癌和死亡病例分别约占全球的17.3%和18.3%,尽管前列腺癌在东亚男性最常见的恶性肿瘤中排名第六。这些数据说明了一个矛盾,虽然前列腺癌仅仅只是东亚第六大最常见的男性癌症,但由于庞大的人口规模和社会老龄化,新诊断和新死亡人数很大。东南亚同期的发病率和死亡率与东亚相似;然而,东南亚地区只有6.9%的人口是≥65岁,所以东南亚前列腺癌的疾病负担比东亚小得多。不同的人口规模和年龄结构影响了病例的绝对数量,但是并没有反映在ASR中。
在亚洲亚区域内,前列腺癌的流行病学特征也各不相同(FIG1)。在东亚,不同国家的最高发病率最高和最低发病率之间相差约为5倍(5.1)。然而,在中南亚(7.0)、东南亚(8.6)和西亚(8.0),这种差异增加到7倍以上。国家间的死亡率差异变小,但仍然存在(亚洲分区域的死亡率范围从1.1到6.7)。分区域的分配是基于地理位置,以及提高人口环境的一致性(同质性)。然而,在亚区域内观察到的差异表明,前列腺癌的流行病学特征也受到社会经济因素和卫生保健系统的影响。
人类发展指数(HDI)是通过健康、教育和收入三个子变量来综合衡量国家成就的指数,包括预期寿命、受教育年限和人均国民总收入。三个部分都被标准化为0和1之间的比例,并且最终的HDI以这三个分量的几何平均值计算。由于HDI是一种平均衡量标准,它掩盖了国家内部的差异,因此必须用其他指标补充,如地区、种族和民族。健康和收入等亚变量与前列腺癌的风险因素如年龄和西方的生活方式有关;在36个国家的全球分析中,HDI与前列腺癌发病率相关(r=0.58,P<0.001)。尽管亚洲地区从1990年至2019年的HDI组分有显著改善(例如,中国的HDI在1990年为0.499,在2019年为0.761),巨大的差异在国家之间仍然存在。2019年亚洲国家的HDI水平从低(阿富汗为0.511)到极高(新加坡为0.938),被认为与前列腺癌发病率相关(阿富汗每10万人中有6.1人,新加坡每10万人中有34.31人)。然而,在标准化死亡率与HDI之间没有发现显著的相关性(r=0.09,P=0.2)。
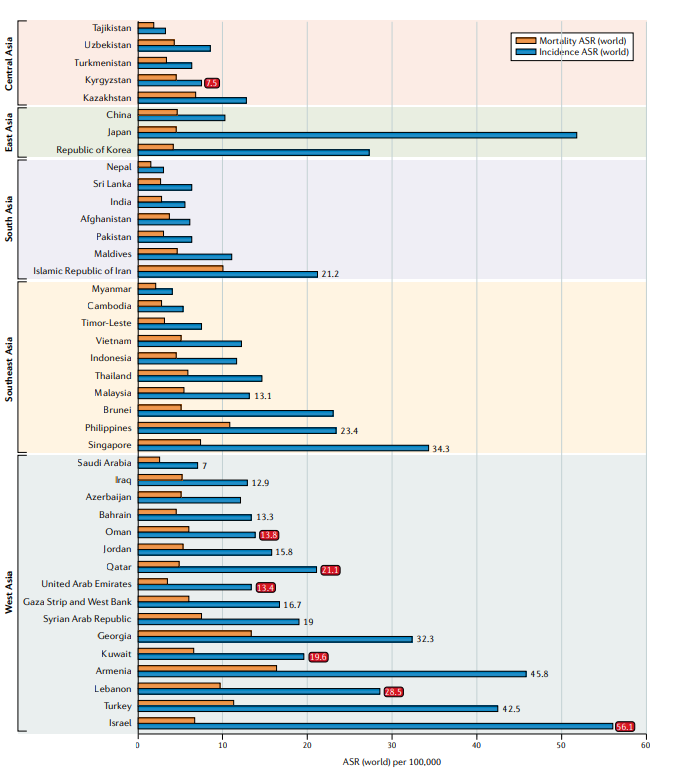
Fig.1 2020年亚洲国家前列腺癌的年龄标准化发病率和死亡率。如果前列腺癌是男性最常见的三种癌症之一,则提供发病率数字;如果前列腺癌是该国男性最常见的癌症,那么这个数字就是红色的。图中所示的数据最初来自GLOBOCAN 2020研究。ASR,年龄标准化率(世界)每10万人。
有趣的是,前列腺癌发病率差别很大,甚至在HDI很高(>0.8)的国家以色列(HDI=0.919)的前列腺癌发病率几乎是韩国(0.916)的2倍,几乎是沙特阿拉伯(0.854)的8倍。尽管使用综合指数可能不强调三个子变量的多样性,但教育和健康与经济学有着密切相关。因此,前列腺癌发病率的广泛差异或许更有可能反映出HDI未捕获的风险因素的差异,如种族和文化。MIR与HDI(P<0.001)高度相关,表明HDI的增加与前列腺癌结局的改善相关。HDI与医疗保健系统的质量相关,因此,这可能会提高癌症治疗的早期检测和有效性,降低前列腺癌的死亡率。在1963-2006年在南亚和东亚进行的18项前瞻性队列研究的综合分析中,肥胖和/或吸烟和前列腺癌之间没有很强的相关性。这一观察结果可能反映了整个亚洲国家的种族背景和癌症筛查方案的重大变化,而这些变化在数据分析中没有进行校正。由于社会经济数据不足,因此关于整个亚洲前列腺癌的潜在风险,无法得出可靠的结论。
对2020年全球前列腺癌发病率和死亡率趋势的回顾显示,44个国家中的40个和76个国家中的73个分别呈下降和稳定。我们小组评估了2003-2016年16个亚洲登记处的流行病学趋势。值得注意的是,亚洲的癌症登记资源仍然有限,只有8个亚洲登记处同时包括发病率和死亡率趋势。缺乏高质量的癌症登记与许多亚洲国家的发展中性质一致,并且影响了整个大陆的流行病学概况。在南亚等发展中地区,只有一个登记处包含了9个国家的数据。
发病率和死亡率的年平均百分比变化(AAPC)使用指定时期内年百分比变化的加权平均,总结了随时间变化的总体趋势;在亚洲国家可以观察到不同的流行病学变化模式(FIG2)。韩国、科威特和香港的发病率不断上升,但死亡率稳定。日本和以色列的死亡率有所下降,相反,泰国、乌兹别克斯坦和哈萨克斯坦报告2007年至2016年的死亡率上升。
整个亚洲也有特定年龄的死亡率趋势(FIG3)。在日本和以色列,2007年至2016年老年男性前列腺癌死亡率(AAPC=−2.6,日本70-79男性P<0.01,AAPC=−2.2、以色列80岁以上男性P<0.01)显著下降,与美国同期的趋势相似。死亡率的降低可能与这些国家在年轻时的早期前列腺筛查(例如,日本建议从50岁起进行PSA筛查)有关,这导致了老年人口致命疾病的显著减少。
泰国(AAPC=6.3,P<0.01)和乌兹别克斯坦(AAPC=14,P<0.01)显示,2007-2016年期间前列腺癌死亡率显著增加,从年龄相对较小(泰国为50-59岁,乌兹别克斯坦为60-69岁)开始,并且维持了在老年群体(70-79岁)中的增长。由于在>70岁的男性中很少进行PSA筛查,这种增加反映了侵袭性前列腺癌的风险因素的增加,如在与老龄化相关的社会经济和生活方式的过渡过程中,动物脂肪和红肉等能量摄入的增加。此外,由于亚洲发展中国家缺乏PSA筛查和亚洲发展中国家的药物供应能力较差,有50%以上的患者被诊断为晚期疾病,生存结局较差。
Table1:估计2020年亚洲和其他洲的前列腺癌的发病率和死亡率
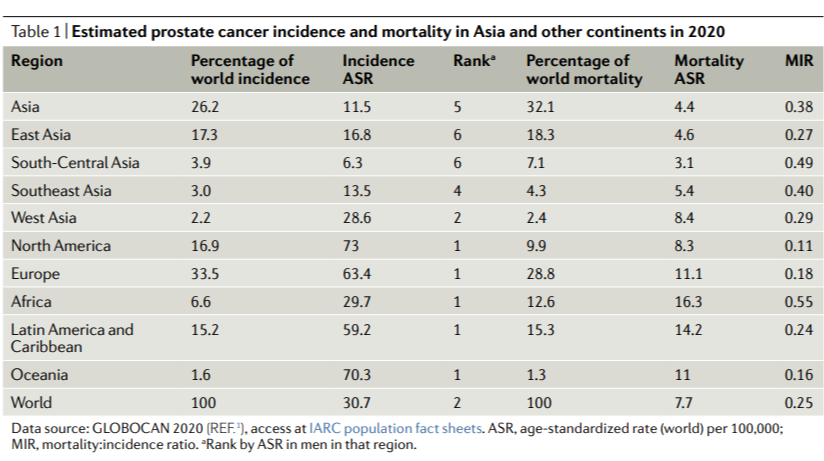
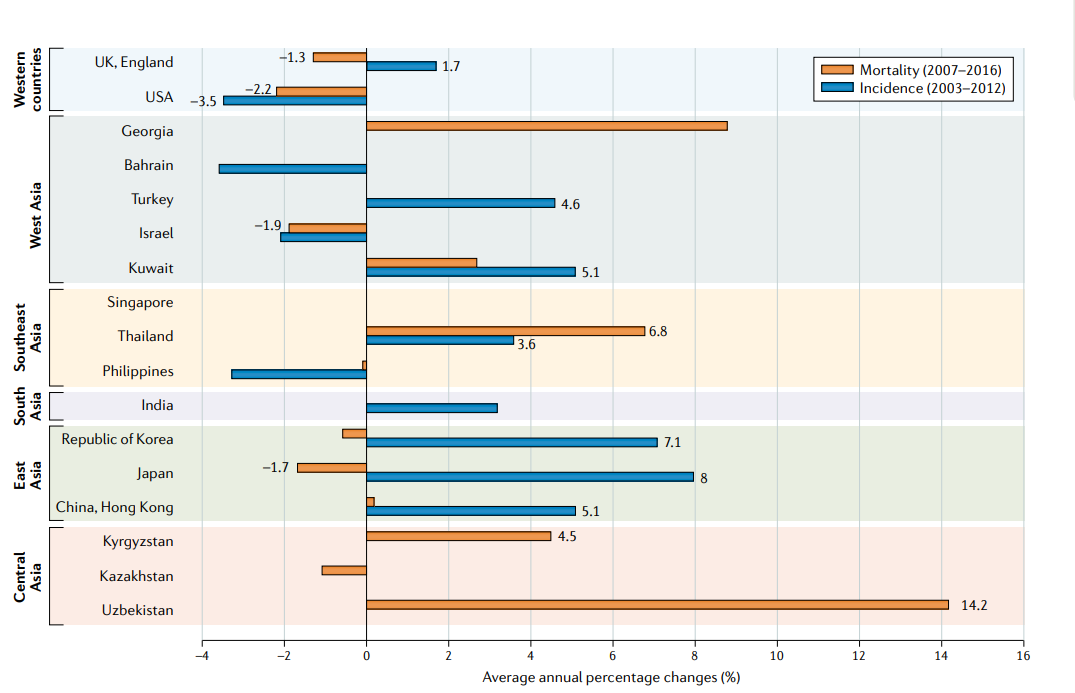
FIG2:亚洲国家、英国和美国前列腺癌发病率和死亡率的年平均百分比变化。发病率数据来自2003-2012年,死亡率数据来自2007-2016年。统计上显著的变化用值进行标记。使用连接点回归程序计算的值(4.8.0.1。2020年4月;国家癌症研究所统计研究与应用分所)
癌症的流行率由发病率和生存率共同决定,并且描述了健康服务上的癌症负担。2020年,在西亚18个国家的16个国家中,前列腺癌是第三大恶性肿瘤。在新加坡、日本和韩国等高度发达的地区,前列腺癌也是男性中最常见的癌症之一(分别是第一、第一和第三)。尽管前列腺癌在中国男性常见癌症中排名第四,但中国患者占亚洲总病例的34.2%。韩国登记数据显示,2002年至2009年间,前列腺癌患病率年均增长26.2%,是韩国泌尿生殖癌中增长速度最快的。
亚洲男性的风险因素。评估不同风险因素对前列腺癌发病率和死亡率的影响的纵向研究为前列腺癌的致癌作用提供了新的见解。然而,具有前列腺癌筛查史详细信息的大型前瞻性队列研究很少。来自日本公共卫生中心的前瞻性研究(JPHC)的数据表明,西式饮食,高摄入肉类和加工食品,包括加工肉、鳗鱼、乳制品、饮料和酒精,可能会增加患前列腺癌(HR 1.22,P=0.021)和局部性前列腺癌(HR 1.24,P=0.045)的总体风险。相比之下,在未通过筛查检测到的有症状的受试者中,高摄入蔬菜、水果、面条、土豆、豆制品、蘑菇和海藻,会降低总体前列腺癌(HR 0.71,P=0.037)和局部前列腺癌(HR0.63,P=0.048)的风险。这种饮食在东亚很传统,而东亚的前列腺癌不太常见(ASR发病率在男性癌症中排名第六)。有趣的是,对东亚和南亚18名前瞻性人群的汇总分析没有发现体重指数(BMI)、吸烟或饮酒与前列腺癌死亡率有显著关联。这些零关联与来自西方人口的数据形成了直接的对比。这些相互矛盾的结果是由于癌症筛查的混杂因素,这在亚洲人群中很少进行,但在西方人群中很常见,或者暗示亚洲男性存在不同的前列腺癌病因学,值得在亚洲人群中进行更多的前瞻性研究。
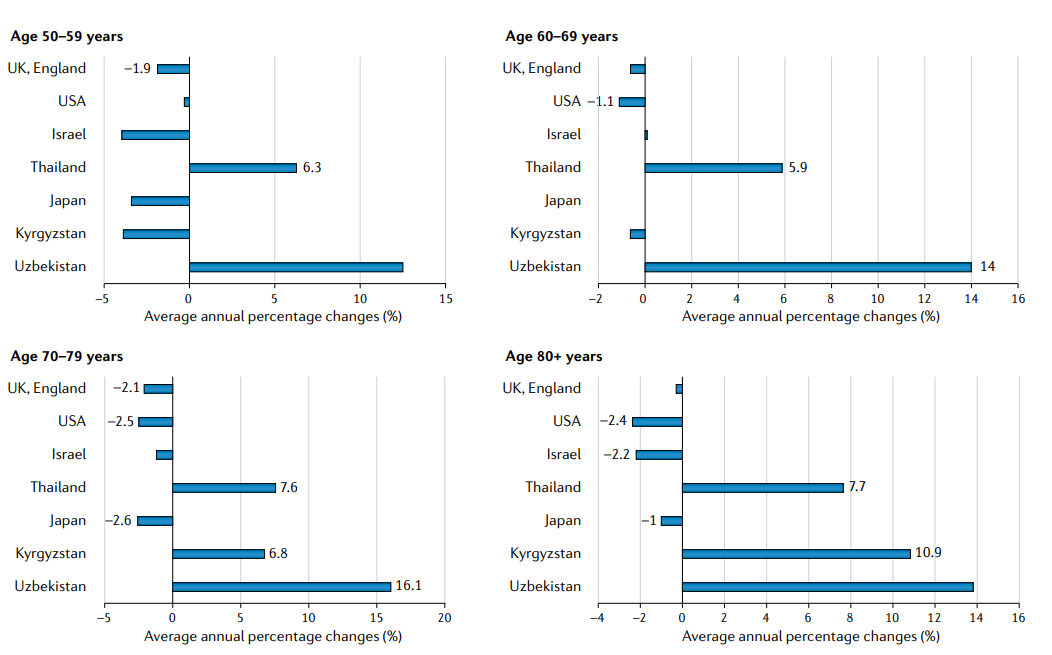
FIG3:选定亚洲国家、英国和美国的年龄特异性前列腺癌死亡率的年平均百分比变化。死亡率数据来自2007-2016年期间。统计上显著的变化用值进行标记。使用联合点回归程序计算的值(4.8.0.1。2020年4月;国家癌症研究所统计研究与应用分所)
在20世纪末和21世纪初,亚洲迅速发展的经济体与生活方式的巨大变化有关。根据中国健康与营养调查,1991年至2011年,中国男性的总体力活动下降了31%。相比之下,从脂肪中摄入卡路里的百分比从1982年的18.4%上升到2012年的32.9%。因此,1989年至2011年期间,中国男性体重指数≥27.5kg/m2的比例从1.45%上升到14.99%。尽管肥胖症的增加与前列腺癌发病率迅速增加(2000-2005年年变化=12.6%,P<0.05)相关,但由于缺乏调整混杂因素的流行病学研究,因果作用仍不确定。
欧洲前列腺癌筛查试验(ERSPC)的随机研究报道,在16年随访时的前列腺癌筛查使死亡率降低了20%。更重要的是,ERSPC证明,为了避免1例前列腺癌死亡,需要邀请接受筛查的人数从9年随访的1947人减少到16年随访的570人,这表明过度筛查的危害随着随访时间的延长而降低。然而,在ERSPC筛查试验中,未筛查组的前列腺癌风险为每1000例男性患有86.95例。低发病率的亚洲国家的效益和成本(亚洲前列腺癌发病率为欧洲的六分之一)仍不清楚。
日本是亚洲唯一一个在普通人群中提倡进行PSA筛查的国家。日本前列腺癌筛查的前瞻性队列研究是亚洲正在进行的单一前瞻性对照前列腺癌筛查研究;它计划在2020年进行死亡率变化分析。日本泌尿学协会在2008年引入了前列腺癌筛查指南,并且2015年的一项年度调查显示,83%的日本城市已经采用了筛选。在日本,前列腺癌筛查与诊断时转移性疾病的比例下降有关。日本泌尿学协会进行的一项大型全国性调查表明,转移性疾病的比例从2000年的21.3%下降至2004年的11.6%。相比之下,拥有与日本有相似种族背景的中国报告,30.5%的患者在诊断时诊断出有转移性疾病。日本广泛的PSA筛查方案也与2007年至2016年国家死亡率显著下降(AAPC=−1.7%,P<0.05)相关(FIG4)。
根据基线PSA水平应用不同的筛查间隔可以作为降低人群筛查成本的一种手段。亚洲国家已经建立了不同的医疗保健体系,日本和韩国等高收入和老龄化社会国家已实现相对公平的医疗保健全民覆盖,而老挝和柬埔寨等欠发达国家的自付支出仍较高。此外,中国城乡居民的医疗服务覆盖率不同,马来西亚有公共和私营医疗部门,导致获得医疗机会具有差异性。
亚洲卫生保健系统的多样性意味着应采用不同的筛选政策,以便能够公平地获得负担得起、高质量的护理,以及财政可持续性。例如,日本泌尿学协会建议,如果以前的PSA为≤1ng/ml,则每3年进行一次PSA筛查,如果最近的血清PSA水平为>1ng/ml,则每年进行一次筛查。然而,亚洲国家前列腺癌的异质流行病学状况意味着决定是否和如何筛查应该基于多种因素,如转移性疾病的百分比、MIR和前列腺癌在男性恶性肿瘤的排名,而不仅仅是使用西方国家引入的方案。
大多数亚洲国家还没有建立一个前列腺癌筛查方案。尽管日本泌尿学协会提倡PSA筛查,但基于PSA筛查可降低前列腺癌死亡率的证据不足,日本的国家癌症筛查计划把PSA筛查限制在机会性的环境中,而不是作为一个基于人群的项目。前列腺癌筛查没有包括在泰国和韩国的国家癌症筛查项目中。事实上,许多亚洲国家没有针对任何癌症的正式的癌症筛查方案,主要是因为其还在发展中的经济、医疗保健的高自付率和极不完善的初级保健系统。
CONCORD(康科德)是一个由伦敦卫生和热带医学学院领导的全球癌症生存监测项目,已经发表了三项研究。第一项研究发表于2008年,分析了1990-1994年间被诊断出来的患者;CONCORD-2发表于2014年,包括1995-2009年间被诊断出来的患者;最近的研究CONCORD-3,包括2000-2014年间的患者数据,于2018年发表(表2)。
根据康科德的数据,在1995年至2014年的20年里,13个亚洲国家中有12个(表2)以及全球大多数国家的前列腺癌年龄标准化5年净存活率有所改善。然而,这些增长的速度是各不相同的。在日本和韩国,前列腺癌的生存率平均每5年增加12%,两者都在东亚,并且在2010-2014年,日本和韩国的存活率接近90%。在印度,尽管生存率显著提高(每期平均变化率为33.7%(P<0.05),前列腺癌患者的5年净生存率仍然是亚洲国家最低的(2010-2014年为44.3%),不到日本和韩国的一半。
除日本以外,所有亚洲国家的晚期疾病发病率(范围在25-44%)都高于美国(19%)(FIG4) 这种现象的部分原因是在2008-2018年间采用了日本泌尿外科协会推荐的前列腺癌筛查。2010年,68%的日本地方市政当局将基于人口的PSA筛查作为一项公共服务开展;在其他类似的发达国家,如韩国和新加坡,这些国家没有在全国范围内进行前列腺癌筛查,也没有专业医疗保健协会的推荐,近三分之一的男性在诊断时出现转移性疾病。尽管很难获得有关分期的全国数据,但亚洲发展中国家转移性疾病的流行率甚至更高。
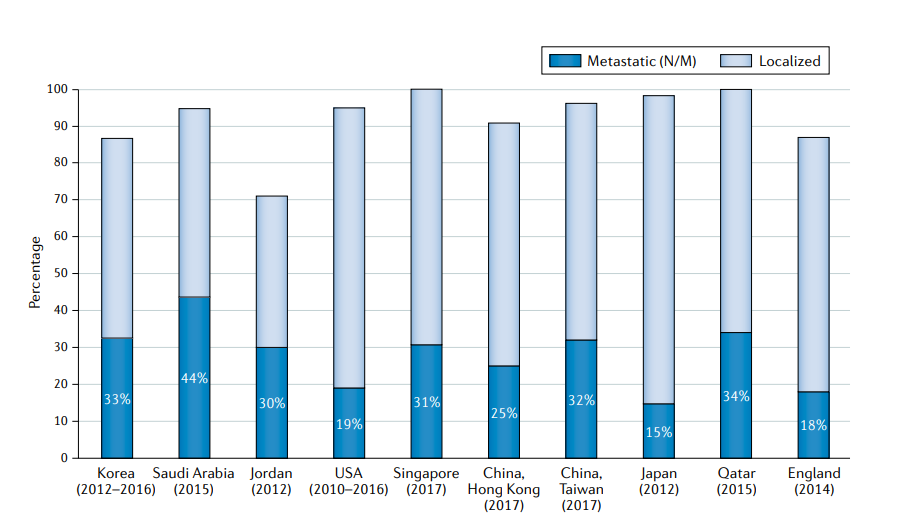
FIG4:在选定的亚洲国家,英国和美国转移性前列腺癌的流行率。除日本外,许多亚洲国家的晚期疾病发病率(25-44%)高于美国(19%)。在此期间,日本广泛的PSA筛查方案与全国死亡率的显著下降有关。Localized(局限性的) vs Metastatic (转移性的)
Table2:亚洲和美国前列腺癌5年标准化净生存率
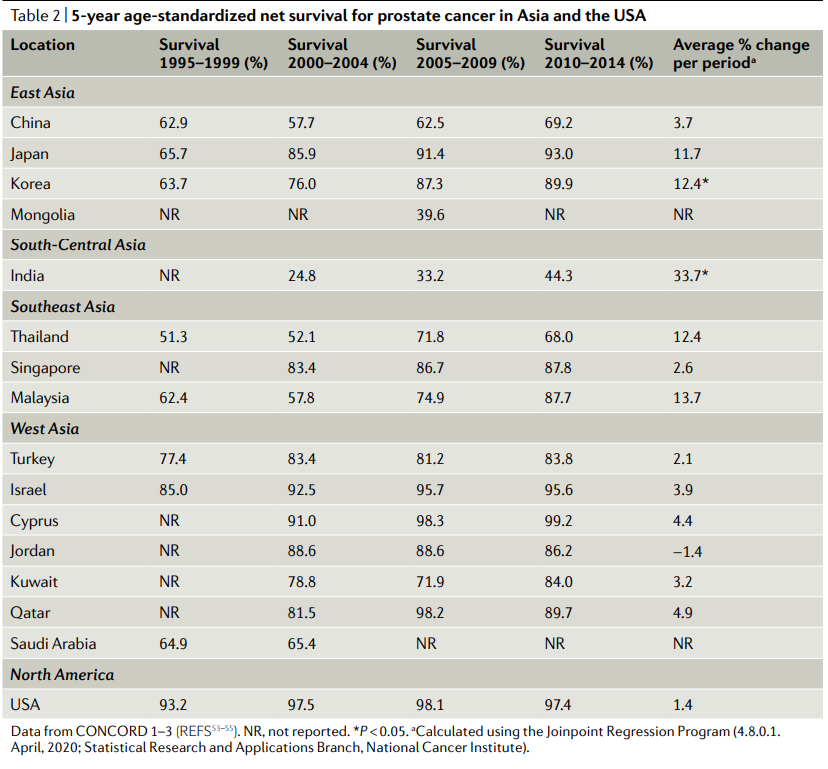
数据来自CONCORD 1-3;NR,未报道;使用连接点回归程序计算(4.8.0.1.2020年4月;国家癌症研究所统计研究与应用分会)
生存率改善的趋势主要是由于向局部疾病的阶段迁移引起的。2003年至2013年,韩国国家健康协会对韩国国民健康保险患者的随机样本调查显示,前列腺癌手术从22.4%增加到45.4%(P<0.001),而雄激素剥夺疗法(ADT)在这段时间内从60.3%下降至45.4%(P=0.02)。更多筛查发现的癌症诊断会导致提前时间偏差,这可以增加前列腺癌的5年生存率。缺乏筛查和随后的高转移性疾病率(中国为30.5%,印度为23.7%)导致生存率下降(分别为69.2%和44.3%)。此外,晚期前列腺癌患者的结局取决于治疗质量,这在亚洲发展中国家和发达国家可能有所不同。例如,2019年之前,阿比特龙和恩扎卢胺等延长生命的药物在中国和印度都没有获得报销或仅获得部分报销,而在日本和韩国则获得全额报销。由于缺乏阶段特异性生存数据,很难从提前时间偏差中区分出治疗改善的贡献。然而,临床护理进步的生存效益(<1.5年)远低于诊断前置时间(5.4-6.9年)。因此,在一些亚洲国家,观察到的生存率的改善在很大程度上可以归因于采用了早期诊断。
1999年,一项在PSA预筛查时期(1973-1986年)评估亚裔美国男性前列腺癌发病率的研究报告显示,美国的亚洲移民前列腺癌发病率最低(上海出生的中国男性每100000人中1.7人),其次是第一代移民(每100000中23人),其次是美国出生的亚裔美国男性(每100000中37人),并且最高的是美国出生的白人(每100000中58.3人)。西化生活方式增加前列腺癌发病率的现象与1983至2013年日本居民的潜伏性前列腺癌的发病率增加了一倍有关(43.3%和20.8%)。这些观察结果强调了遗传背景和生活方式特征在前列腺癌癌发生中的重要性。
来自加州癌症登记处的数据表明,华裔和日本裔亚裔美国男性比非西班牙裔白人患者更有可能患高危前列腺癌,这主要是由Gleason评分高的几率增加造成的。SEER数据库的数据观察到的类似的结果表明,与美国白人相比,亚裔美国男性的PSA水平(中位数:亚裔7.2 ng/ml vs 美国白人6.7 ng/ml,P<0.01),Gleason评分(8-10:19.1% vs 18.7%,P<0.01)和阶段(cT3/4:2.7% vs 2.3%,P<0.01)显著增加。尽管临床病理特征较差,但在调整了年龄、PSA、Gleason评分、临床分期和治疗类型等协变量后,亚裔美国人的非转移性(HR 0.6, 95% CI 0.54–0.65)和转移性疾病(0.62, 95% CI 0.57–0.69)的生存率都显著高于美国白人。种族对前列腺癌生存率的影响表明,不良病理预测工具的应用可能无法转化为亚洲人群的生存结果预测。大多数研究以肿瘤病理学作为主要终点,包括一些长期的终点。因此,白人患者的不良病理的预后价值可能高估亚洲患者的长期结局,并可能转化为过度治疗。此外,基因组标记中的表达模式似乎因种族而异,需要大量的研究来校准长期的终点。不幸的是,基于组织的前列腺癌风险分层测试,如 Decipher, Oncotype DX, Prolaris 和ProMark,很少能在亚洲患者中使用。2020年,一份初步报告分析了新加坡31名前列腺癌患者的Decipher基因分类。在本研究中,9名NCCN高危患者中有5例降为基因组分类中等风险,而6名NCCN中危患者中有4例在基因组分类上有高风险评分。在存在生存相关性的队列中,基因组分类的差异是否解释了组织学分层的不同预后意义还有待进一步探讨。
亚洲(特别是东亚)和西方人口之间的前列腺癌流行病学差异提出了一个问题:潜在的基因组差异是否可以解释不同的肿瘤特征,以及这些差异是否可以转化为临床实践的变化,特别是在精准医学时代。有几个小组已经评估了这一假设,缩小了我们理解前列腺癌中种族差异的差距,并致力于为更广泛的种族多样性提供精准的医学方法。
值得注意的是,任何观察到的基因组差异都应在不同国家的PSA筛查率差异的背景下进行解释。在美国,有6%的男性患有转移性疾病,而近三分之一的中国男性患有远处转移疾病。然而,PSA筛查会导致惰性前列腺癌的过度诊断;因此,亚洲和西方患者之间观察到的分子差异可能部分归因于PSA筛查后诊断时惰性和侵袭性前列腺癌的不同发病率。因此,亚洲发展中国家PSA筛查的日益普及为评估筛查对前列腺癌分子特征的影响提供了一个很好的机会。
总体而言,中国男性前列腺癌的突变负荷较低,拷贝数改变和染色体重排增加,这都与美国男性相当。根据基于前列腺癌7个重要致癌因子(ERG、ETV1、ETV4、FLI1、SPOP、FOXA1和IDH1)的癌症基因组图谱(TCGA)分类,68.4%的中国男性前列腺癌和61.6%的美国前列腺癌可归属于TCGA分类之一。此外,在TCGA中的中美队列成员在前列腺癌的12个关键的致癌通路上也有相同的改变。这些数据表明,亚洲和西方研究中发现的反复出现的基因组畸变之间存在相似性,但在关键畸变的频率和独特的改变模式方面存在一些差异。
在白人男性中,与前列腺癌相关的最常见的体细胞改变是ETS融合(46%),这些融合的存在与否可用作前列腺癌的分子分类。ETS融合阳性病比ETS阴性病更有可能发生PTEN缺失,而ETS融合阴性癌也可能发生SPINK1突变、SPOP突变、CHD1缺失和DNA损伤修复(DDR)基因突变(~19%:BRCA1、BRCA2、RDA51C、FANCD2,ATM;8-12%:MSH2、MSH6、MLH1)。
与北美和欧洲的白人男性相比,亚洲前列腺癌的基因组改变的定义并不明确,而且大多数研究都是在中国和日本男性中进行的。
由于缺乏包括不同种族的男性在内的正面研究,群体之间的基因组比较通常是基于已发表的具有不同疾病特征的队列、测序平台和生物信息分析管道,这阻碍了得出分子差异的明确结论。另一个重要的缺点是,大多数对亚洲男性的研究缺乏生存结果或治疗反应;因此,这些差异是否可以转化为临床相关的终点在很大程度上尚不清楚。
ERG癌蛋白。ERG是一种编码ETS转录因子家族成员的癌基因,占前列腺癌中ETS融合率的90%。TMPRRSS2与ERG(TMPRSS2-ERG)的融合导致AR驱动的ERG表达异常,促进肿瘤发展。2018年的一项研究计算了不同种族的前列腺癌男性的加权ERG癌蛋白频率。研究报告显示,在日本、韩国和中国,13-22%的男性前列腺癌患者患有ERG+肿瘤,而在来自欧洲和美国的欧洲血统患者中,有43-53%患ERG阳性肿瘤。ERG基因在不同种族前列腺癌亚组之间的差异性表达强调了在致癌机制的研究中需要包括人群背景。然而,这些回顾性分析应该在一项国际研究中进行前瞻性验证。
IPATential150是一项全球III期临床试验(NCT03072238),正在评估帕他色替和阿比特龙联合治疗转移性去势抵抗性前列腺癌(mCRPC)。该研究涉及来自韩国、台湾、泰国、日本和中国的亚洲患者,包括东亚和其他国家之间的生物标志物分析(通过前瞻性登记、大样本量和对生物标志物评估的中心分析平台的使用得到加强)。在IPATential150试验中,82%的样本是在最初确诊后5个月内获得的。对生物标志物的研究结果表明,分子改变发生在治疗前,可能不能反映去势耐受性的变化。根据子代测序,东亚男性(15%,n = 140)较其他国家患者(35%,n=595, P<0.001)的TMPRSS2重排发生率明显偏低。IPATential150的这些数据与另一项比较了日本男性偶发(膀胱前列腺切除术后)和转移性前列腺癌的分子特征的研究一致。在这项研究中,15.2%的偶发疾病患者为ERG阳性,与转移病例中ERG阳性的患病率(14.3%)相当。这些发现表明,这一人群中ERG癌蛋白的低发生率不能用PSA筛查来解释,而更可能是东亚男性前列腺癌的固有特征。
与白人男性相比,非洲裔男性前列腺肿瘤的ERG融合率也较低;2014年的一项研究显示,非洲裔男性的ERG重排水平远低于美国白人男性(分别为27.6%和42.5%; P=0.024)。亚洲男性的前列腺癌比白人男性少,非洲裔美国男性的前列腺癌比白人男性更常见,但两者的ETS融合率都很低,这一事实似乎是相互矛盾的。这些数据进一步说明了前列腺癌发生的复杂性,并强调需要对不同种族的男性进行更多的比较研究,以构建全面的基因组图谱。
大多数评估亚洲ERG表达的研究来自东亚,占有文献报道的患者的86.8%。一些研究表明,在整个亚洲,ERG表达存在异质性。在东亚国家,这一比例相似,为21-25%,然而在报道的329名印度前列腺癌男性中ERG阳性率为52%,在99名土耳其前列腺癌患者中为46%。此外,在一项80名马来西亚患者的多民族研究中,印裔男性的ERG阳性率(69%)显著高于华裔(40%)和马来裔(44%,P=0.031) 。这些研究虽然基于很小的数字,但强调了观察到的ERG低发病率可能仅限于东亚人口,亚洲其他地区还需要更多的数据。基因背景、生活方式因素以及发展水平的组合差异可能解释了亚洲各地ERG阳性比率的差异。
在633例中国前列腺癌患者中ERG表达和前列腺癌的人口统计学特征显示,ERG表达的患者(P =0.004)比不表达的患者更年轻,且具有高Gleason分级组(≥4,P=0.027)和导管内癌(P = 0.012)等不良病理特征的可能性较小。ERG表达还与发展为去势耐受性疾病的概率降低相关(P = 0.042)。然而,来自另一组669名接受根治性前列腺切除术的前列腺癌男性的数据没有证实ERG与临床病理结果之间的联系。虽然这两项研究报告的ERG阳性患病率相当(16.7%和16.4%),但它们提示ERG畸变的预后价值并不确定,可能与接受的治疗(ADT或手术)有关。
PTEN。在一项对7,813名接受了根治性前列腺切除术的德国白人男性前列腺癌患者的研究中,24.2%存在 PTEN丢失,且PTEN丢失的发病率从患Gleason 3 + 3肿瘤的男性的14%增加到患Gleason≥4 + 4疾病的男性的40.7%。在156个来自英国的前列腺癌患者和84名中国患者中评估PTEN缺失率的研究发现,尽管中国患者患Gleason评分≥8疾病的比率更高(中国患者57%,英国患者29%),只有14.3%的中国男性患者出现PTEN缺失,而英国患者的这一比例为42.3%。IPATential150试验报告显示,与来自其他国家进展为mCRPC的男性患者相比,东亚男性前列腺癌中PTEN损失的发生率明显较低(15% vs 31.3%,P < 0.001)。
PTEN缺失的表现是PI3K-AKT-mTOR通路的激活,该通路可能对靶向药物敏感。在对253名欧洲裔男性进行帕他色替治疗mCRPC的II期试验中,在43.0%的病人中发现PTEN损失。在PTEN损失组中,与作为对照组的安慰剂加阿比特龙相比,帕他色替加阿比特龙的放射学无进展生存风险比(HR)为0.39(帕他色替 400 mg加阿比特龙)至0.46 (帕他色替200 mg加阿比特龙)。考虑到PTEN在大多数亚洲人群中的低流行率,靶向药物试验计划和招募需要仔细考虑。确定亚洲PTEN损失测试的特定人口统计学和临床亚组也许有助于优化识别可能受益于靶向治疗的患者。
SPINK1、SPOP、CHD1和DDR基因。在ETS融合阴性前列腺癌中,SPINK1、SPOP和CHD1是常见的改变基因,而CHD1缺失会导致类似于DDR基因改变的DNA修复缺陷。在一项对日本男性前列腺癌患者的研究中,SPINK1(一种编码细胞生长和促进肿瘤发展的生存因子的基因)通过对膀胱前列腺切除术标本的免疫组化研究发现:在患偶发性前列腺癌的46名男性中6.5%为阳性,在患新发转移性前列腺癌的98名男性中12.2%为阳性。SPINK1阳性率与中国患者(7.6-13.5%)相似,也与美国、荷兰和德国患者(1577例接受了根治性前列腺切除术的患者中的8%)相似。
SPOP在前列腺癌中起肿瘤抑制作用并靶向多种癌蛋白,包括AR、CDC20、MYC、ERG、SRC3、PDL1和BRD4。相比在美国和英国的局限性前列腺癌患者(7.0%)和mCRPC患者(9.3%)而言,SPOP突变在中国局限性前列腺癌患者(208例中的14.1%)中富集。一项前瞻性试验中纳入的男性生物标志物分析证实,发展为mCRPC的东亚患者中SPOP突变的患病率明显高于其他亚洲地区(14.3% vs 6.2%;P < 0.01)。
CHD1是一种染色质重构,通过限制AR结合和肿瘤发展来发挥前列腺肿瘤抑制因子的作用。65名男性原发性前列腺癌患者中,中国患者CHD1删除的比例大约是TCGA报道的患者的两倍(31%:16%),而DDR基因突变被发现在6% (ATM 3%, ATR 1.5%, BRCA1 1.5%)的中国患者和12%的TCGA 患者身上。208例中国男性局限性前列腺癌患者的数据进一步表明CHD1突变的高患病率(17.8% :4.4%的美国患者;P = 3 × 10−4)。在一项对患有mCRPC的男性进行的试验中,东亚男性和来自非东亚地区(如北美、欧洲和大洋洲)的男性之间的基因组改变的比较显示了BRCA2改变的高发生率(东亚男性12.1% :非东亚地区男性5.2% ; P < 0.01)、CDK12改变的高发生率 (12.9% :4.2%, P < 0.001)和相似的ATM改变发生率 (7.1% :5.4% ;不显著)。由于CHD1和DDR基因与PARP抑制反应相关,中国男性前列腺癌患者中可靶向突变的高流行率值得进一步验证。
FOXA1。FOXA1是AR介导的基因调控和信号转导的先锋因子。2019年发表的两项研究描述了前列腺癌中FOXA1突变的致癌机制,并描述了不同类型FOXA1改变的表型效应。2020年,Li等人发表了208例对中国原发性前列腺癌患者肿瘤组织样本和匹配的健康对照组织的全基因组、全转录组和DNA甲基化数据(92.8%患者为M0型, 54.3%患者的肿瘤Gleason评分≤7)。他们报告称41%的中国局限性前列腺癌男性组织包含FOXA1突变,而美国的患者(TCGA)中只有3.5%的局限性肿瘤组织和15.3%的mCRPC组织包含FOXA1突变。
有趣的是,FOXA1的突变谱在中西方患者中是不同的。在美国的患者人群中,突变覆盖了整个编码序列,而在中国患者中,所有突变都发生在分叉头结构域之后的热点区域内,该区域介导DNA结合,例如AR相互作用。此外,中国男性FOXA1突变中26个为错义突变,63个为插入缺失突变。大多数错义突变和框内插入缺失突变是激活突变,使染色质移动性和结合频率增强。此外,在美国患者中发现的另外两种FOXA1改变(截短的c端结构域和基因组重排)促进了前列腺癌的转移发展。因此,所有的中国男性FOXA1表达增加的例子都是在FOXA1突变的肿瘤中发现的,而不是在FOXA1野生型肿瘤中,FOXA1表达增加的男性也有AR信号基因特征的增加。中国男性的FOXA1突变与ETS融合相互排斥,但与CHD1删除 (P = 0.001)和CECR7-IL17RA基因融合(P = 0.002)显著同时发生。最后,烟酸盐代谢途径和雄激素代谢催化剂,如HSD17B6,在FOXA1下游上调。这些数据表明FOXA1通过雄激素途径在中国前列腺癌的癌变中起重要作用。
其他在亚洲病人中经常发生突变的基因。一项来自中国的研究对65名未接受治疗的中国前列腺癌患者(非转移性:37% Gleason评分≥8, 40%≥T3)的肿瘤和良性配对组织的全基因组和转录组进行测序,结果发现了新的基因,随后在145名中国患者和来自TCGA、MSKCC和MGH的美国患者的数据中得到验证。该研究报道称23%的中国前列腺肿瘤存在PCDH9缺失或丢失,17%的前列腺肿瘤存在PLXNA1增加和/或扩增。在对北美患者TCGA数据的分析中,37%的前列腺癌出现PCDH9缺失或丢失,17%的前列腺癌出现PLXNA1基因扩增。PCDH9是原钙粘蛋白家族的成员,在细胞粘附、神经信号传导和致癌过程中发挥作用。PCDH9的低表达和拷贝数丢失分别与TCGA和MSKCC转移组各自的生化复发率增加和总生存率降低显著相关(P=0.013和0.019)。PLXNA1编码信号素受体,信号素作为轴突引导分子并在肿瘤发展中发挥作用。PLXNA1超表达在中国患者中与高Gleason评分(P=0.014)、肿瘤分期(P<0.001)和生化复发率(P<0.001)联系在一起, 在MGH和TCGA队列中,PLXNA1的高表达和拷贝数增加(P=0.002和0.0054)分别与较差的无生化复发生存率显著相关。基因组特征在不同种族和民族群体中的复制提高了我们对前列腺癌遗传多样性的理解,并可以加强新型治疗方法在全球范围内的应用。
SNPs和种系突变可以用来确定前列腺癌的风险,一些SNPs也可以用来分层进行靶向治疗。2019年,PARP抑制剂的试验显示出对DDR突变患者的临床有益,而免疫治疗对错配修复突变患者有益。
与疾病风险相关的基因变异。尽管亚洲人口占全球人口的59.7%,但全基因组关联研究(GWAS)主要在欧洲裔男性中进行,在各种研究中,欧洲裔男性占GWAS所有个体的78%,亚洲男性仅占11%。因此,在包括欧洲血统同质人群的GWAS中,亚洲人群的重要风险等位基因很可能被遗漏。值得注意的是,GWAS并不能阐明许多前列腺癌易感位点的生物学意义。此外,相关性研究可能受到对照组中未确诊的前列腺癌的影响。
迄今为止,前列腺癌的GWAS已鉴定出147个易感位点,占该疾病家族风险的28.4%。这些位点中只有11个最初从两个亚洲群体(日本人和中国人)的GWAS中被鉴定出来,可能是因为在亚洲群体的个体GWAS中使用的样本量较小。对14万多名欧洲血统男性中11个来自亚洲的SNPs的评估发现,这些SNPs中只有3个在这些男性中具有GWAS意义:rs12653946 (OR1.08,P=9.58E-22)、rs1983891(OR1.09,P=1.13E-20)和rs339331(OR1.09,P= 5.35E-22)。然而,这三个亚洲来源的SNPs与前列腺癌易感性之间的联系在欧洲血统的男性中被证实时减弱了。相比之下,Wang等人进行了类似的、相反的分析,对中国和日本GWAS数据中的欧洲衍生SNPs进行了多次重复测试。在来自欧洲或多民族群体的90个SNPs中,只有25个在亚洲meta分析中达到P < 0.05。亚洲的遗传性前列腺癌发病率较低,可能部分解释了这种低验证率:中国男性的前列腺癌家族史的报告率为4.5%,日本男性为6.8%,韩国男性为8.4%,均低于瑞典(11.63%)。
前列腺癌的遗传风险评分的临床影响似乎在与该风险评分派生的同族男性中最强。从大型多民族群体(80.3%非西班牙裔白人和7.0%东亚人)得出的一个普遍的遗传风险评分表明, 在非西班牙裔白人男性(OR 6.22用于比较最高和最低风险评分十分位数)中,遗传风险评分的关联比东亚人(OR 3.38)更为深远。因此,缺乏具有代表性的基因组研究数据可能会影响基因型分层在少数种族群体中的预后价值。
Na和同事开发了东亚人种患者特殊的遗传风险评分,当与人种无关的评分相比时,该评分为预测中国患者的前列腺癌提供了更有利的OR(1.45:1.1)和曲线下面积(0.602:0.573)。此外,东亚特异性遗传风险评分使用的基因座要少得多(7:76),表明遗传背景作为潜在因素在前列腺癌发病率的种族差异中扮演着重要的角色。
遗传突变。Momozawa等人在2019年的一项研究中检测了8个前列腺癌相关种系基因(BRCA2、BRCA1、ATM、CHEK2、PALB2、BRIP1、NBN、HOXB13)在日本男性中的发生率。在12366名无个人或家族癌症史的男性中,致病性变种的发生率为BRCA2 0.2%、BRCA1 0.1%、ATM 0.2%、CHEK2 0.1%、PALB2 0%、BRIP1 0.1%、NBN 0%和HOXB13 0.2%。BRCA1和/或BRCA2的突变率为0.3%,与未被选择的欧洲血统人群中BRCA1或BRCA2的致病突变率1:400相似。
Pritchard和他的同事们对来自美国和欧洲中心的692名转移性前列腺癌患者的20个DDR基因进行了检测。作者发现20个DDR基因的种系突变率在转移性前列腺癌男性中为11.8%,在局限性前列腺癌中为4.6%。相比之下,Wei等人对316例中国前列腺癌患者进行了评估,在12%的转移性前列腺癌男性中发现了DDR基因的致病变异,而只在10%的局部前列腺癌患者中发现,在8.1%的局部高危前列腺癌患者中发现。在转移性疾病中,中国患者DDR基因的种系突变率与白人男性相似,但在局限性疾病中,中国患者的DDR基因突变发生率高于白人患者。这种差异的原因尚不清楚,但与美国患者(67.5%)相比,中国患者患有高风险疾病(74.7%的检测局限性疾病)的概率更大,这是合理的。在7646名不同分期的日本前列腺癌患者中,2.1%的患者中的7个DDR基因有致病性种系突变。与中国患者的突变发生率(所有前列腺癌患者中为9.8%)相比,日本的发生率较低可能是因为本研究中纳入的日本患者中只有8%有转移性疾病。有趣的是,日本患者中超过一半的致病变异是新发现的,没有在ClinVar(人类变异和表型的一个国际档案)中被描述。此外,由于资料缺乏,亚洲患者在基因致病性分类中具有不确定意义的变异的比例高于白人患者。因此,在临床实践中增加对亚洲患者的基因检测不仅有利于对患者的治疗,而且扩大了基因研究中可利用数据的多样性。
前列腺癌中另一个重要的风险位点是HOXB13,它是一个转录因子基因,通过AR相互作用在前列腺癌细胞生长中发挥重要作用。复发性突变G84E是北欧人群中的一种创始突变,有0.1-1.4%的欧洲血统人群携带该突变。基于未选择前列腺癌家族史的病例对照研究,北欧人群前列腺癌综合相对风险评估为3.43 (95% CI 2.78-4.23)。然而,这种变异在亚洲血统人群中非常罕见。在一项针对中国男性的研究中,Lin等人在671名中国患者中没有发现G84E突变,但他们发现了HOXB13中一个新的G135E突变,与没有癌症的中国健康男性相比,前列腺癌男性患者中G135E突变显著增加(P = 0.027)。一项针对7646名日本前列腺癌男性的HOXB13基因的大型研究也未能检测到G84E突变,但发现了一个新的复发变异(G132E),与健康的日本男性相比,G123E与前列腺癌风险增加相关(G132E, OR 6.08, 95% CI = 3.39-11.59)。
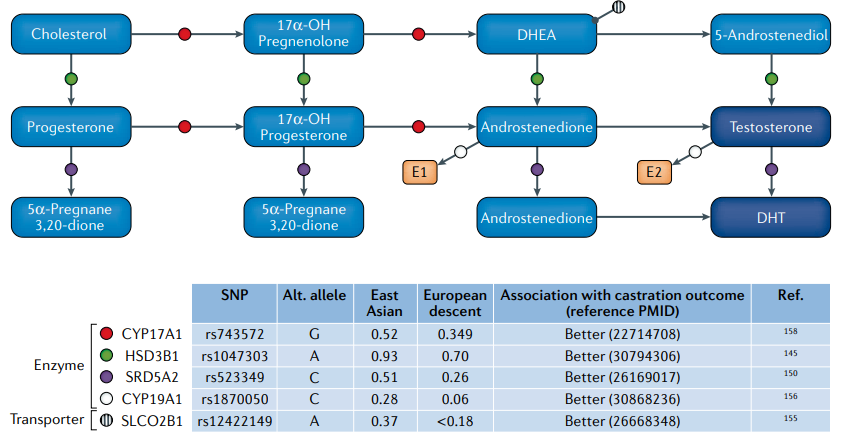
Fig.5雄激素代谢网络和关键调控基因. 东亚男性和欧洲男性之间选择的单核苷酸多态性(SNPs)等位基因频率不同,具有相当大的意义,特别是由于这些改变亚洲男性雄激素剥夺治疗(ADT)的结果得到改善。
G84E变异位于HOXB13 MEIS-interacting的第一个结构域,而G132E和G135E变异位于MEIS-interacting的第二个结构域;MEIS1–HOXB13复合物对于维持MEIS1的肿瘤抑制功能至关重要。令人惊讶的是,HOXB13G84E突变并不是因为干扰HOXB13稳定性或与MEIS1相互作用能力的功能丧失突变。遗传性G84E替代增加前列腺癌发病率的机制尚不清楚。G84E突变与早期发病(OR 2.9, 95% CI 2.24-3.75)和高侵袭性疾病(OR 2.38, 95% CI 1.84-3.08)显著相关,但目前尚无数据支持G132E和G135E变异与临床特征之间的相关性。HOXB13也与AR-V7相互作用以驱动前列腺癌的去势抵抗。这些发现表明,HOXB13的改变在早期发现和治疗机会方面具有临床意义。HOXB13的特异突变是否具有独特的致病和致癌功能有待进一步探索。由于HOXB13被推荐用于NCCN前列腺癌指南中的种系检测,因此应该在东亚男性中探索G132E和G145E的特异性变异。
药物基因组学和睾酮。一些研究发现,亚洲患者的ADT结果可能比北美患者更有利。一项对22293名北美新发转移性前列腺癌男性的人口数据库综述评估了种族对总生存率的影响。该研究报道,亚裔美国男性的总生存率(30个月)高于美国白人、黑人和美国土著男性(23-25个月,P < 0.001)。此外,亚洲男性前列腺癌特异性生存期(54个月)明显长于其他种族背景的男性(35-40个月,P < 0.001)。在多变量分析中,来自亚洲或太平洋岛屿种族背景的男性与白人男性相比死亡率降低了19%。然而,这个基于人群的数据库不包括患者接受的治疗信息。另一项针对日本和美国前列腺癌男性的跨太平洋的比较研究显示,与美国相比,日本患者经过ADT后前列腺癌特异性死亡率降低了48%。不同的基因控制着雄激素的合成、分配和运输途径,并调节ADT的作用(图5),不同的关键基因(HSD3B1、SRD5A2、SLCO2B1、CYP19A1和CYP17A1)的种族差异可能导致了前列腺癌的这种独特生物学特性。虽然这些基因的单一变异可能产生中等效果,但累积效应可能能够区分个体对ADT的反应。因此,比较研究东亚和北美的队列可能阐明ADT应答的遗传特征,有助于计划在初级和/或辅助ADT环境下减少治疗。
HSD3B1调节肾上腺前体转化为强效雄激素(图5)。2019年的一项研究评估了104名接受原发性ADT的日本患者和99名接受mCRPC阿比特龙治疗的男性患者的HSD3B1变异(rs1047303, 1245A>C)。在ADT组,携带AC/CC变异的男性比携带纯合子野生型AA变异的男性表现出更高的进展风险(HR 2.34, P = 0.03)。在阿比特龙组中,携带变异类型AC/CC的男性进展风险较低(HR 0.32, P = 0.006),全因死亡率较低(HR 0.4, P = 0.04)。在来自美国的白人患者中,伴有1245A>C的HSD3B1与ADT耐药相关,但对酮康唑等非甾体CYP17A1抑制剂敏感。在前瞻性CHAARTED试验的一项术后分析中,HSD3B1 1245A>C变异与低容量转移前列腺癌男性去雄抗性(HR 1.89, 95% CI 1.13-3.14)和死亡(HR 1.74, 95% CI 1.01-3.00)的较高风险独立相关。与传统预后因素(包括年龄、PSA、Gleason评分和表现状态)相比,HSD3B1基因型患者的因素与预后之间的相关性更为显著。然而,在东亚男性前列腺癌患者中有0.07个C等位基因,而在欧洲患者中这一比例为0.30(图5),为东亚男性的4倍(图5),这可能部分解释了东亚男性对ADT的良好反应。雄激素代谢基因SRD5A2 (rs523349)和雄激素转运基因SLCO2B1 (rs12422149) 也有类似的结果。这两种基因多态性与美国东亚和白人患者ADT疗效的改善相关,但东亚人群中风险等位基因的流行率低于白人患者。
CYP19A1编码芳香化酶,它将雄激素(雄烯二酮或睾酮)转化为女性激素雌激素(图5)。2019年Shiota等人的一项研究评估了80名接受ADT的转移性前列腺癌患者。接受ADT治疗的人中,携带CYP19A1 rs1870050 (AA)变异的男性血清睾酮水平高于携带AC/CC变异的男性。在多变量分析中,AC/CC变异与CRPC风险进展降低相关(0.53,P = 0.025)。Levesque等人在601名接受ADT治疗的亚洲前列腺癌男性患者的研究中发现,亚洲AC/CC等位基因患者接受ADT治疗后出现了类似的有利结果。在这些患者中,与AA变异相比,AC/CC变异的存在与改善全因死亡率相关(HR 0.7, P = 0.048)。然而,在另一项研究中,Levesque和同事在白人患者中发现了矛盾的结果,在这些患者中,rs1870050 (AC/CC)变异与较高的生化复发风险相关(HR 2.03, P = 0.006)。这些发现得到了Ross等人对529名美国白人患者的分析数据的支持,在这些患者中,rs1870050 AA变异与ADT期间进展时间增加相关(HR 0.6, 95% CI 0.45-0.8)。
除了关于预后的矛盾结果外,该等位基因在亚洲人群中的频率远低于欧洲血统的男性(图5)。这些对比结果也在另一种类固醇生成酶CYP17A1 (rs743572)中发现。该研究表明,在风险等位基因和前列腺癌预后之间观察到的数据是如何相互矛盾的,并需要更多的研究来阐明亚洲和白人男性的潜在机制。
全球前列腺癌统计数据的巨大差异强调,亚洲国家不可能实施“一刀切”的管理方法。虽然越来越多的研究集中在这一不断发展的话题上,但在文献中仍然存在一些空白。
首先,大多数试图验证前列腺癌生物学中种族差异的研究质量都很差。需要多中心、具有良好匹配对照的前瞻性研究,以整合不同生活方式和社会风险因素的生物学数据。第二,大多数研究采用中间结果,如活检结果和病理特征。然而,这一信息并不能为长期预后提供强有力的预测,而评估的最相关的临床结果是死亡率。第三,截至2021年,亚洲学术界还没有建立类似于美国前列腺癌基金会的资助充足的研究机构。为了优先解决这些问题,一个多模式的研究团队应该聚集起来,以提高我们对亚洲男性前列腺癌的了解,并使亚洲患者受益。
亚洲人群诊断时转移性疾病的高发病率(图4)突出了亚洲男性前列腺癌全身药物治疗的重要性。自2015年以来,早期强化治疗的进展,如前期化疗或下一代雄激素阻断对延长患者生存至关重要。然而,亚洲经济发展和卫生保健系统的差异意味着,中国、菲律宾和越南等亚洲发展中国家在登记和报销这些延长生命的药物方面存在相当大的延迟。在贫穷和中等收入国家,使用多西他赛等仿制药和特定方法,如在男性转移性前列腺癌患者的饮食中使用低剂量阿比特龙,可以节省成本并改善治疗的可获得性。与西方国家的实践模式不同,在许多亚洲国家,晚期前列腺癌的口服药物和静脉化疗是由泌尿科医生而不是肿瘤科医生开具的。因此,具体的肿瘤医学培训和继续教育是在这些地区提供高质量护理的必要措施。2019年,原发肿瘤放疗被证明对低容量转移癌男性患者的生存有利,因此强烈建议多学科团队的早期参与。在这片广袤的大陆上,远程医疗可以为平等获得治疗意见提供一种有吸引力的替代选择。
随着前列腺癌发病率的增加,亚洲人口正在迅速老龄化,到2050年60岁及以上的人口将达到18%,而2019年只有8%。发现在年龄高于 70岁成年人群体中,泰国(AAPC = 7.6%)和乌兹别克斯坦(AAPC = 16.1%)的前列腺癌死亡率显著增加(图3)。适当的预处理评估,根据病人的功能但不只是年龄调整治疗,和监测不良事件,在这种情况下是至关重要的。
另一个需要考虑的重要因素是,亚洲的阿片类药物使用不太普遍——与北美患者相比,亚洲患者接受阿片类药物的可能性要低三分之二,而肿瘤负荷高的男性接受阿片类药物的可能性要降低四分之三。决策者和医生必须承认世界各地区阿片类药物使用的可变性,因此在日常实践中解释临床试验结果时应谨慎。晚期前列腺癌新疗法的出现将延长生命的治疗方法扩展到三线或四线使用,这不可避免地导致了相当大的经济负担。与恩扎卢胺或阿帕鲁胺不同,多西他赛和阿比特龙现在可以作为非专利仿制药获得,而且价格合理。低脂餐后给予低剂量阿比特龙,改善了阿比特龙的摄取,效果与标准给药类似,进一步减轻了资源有限地区的经济负担。
亚洲男性高转移率的原因不仅仅是缺乏PSA筛查。生活方式(例如,随着亚洲人口变得越来越西化,肥胖和吸烟可能会变得更相关的风险因素)可以增加患侵略性前列腺癌的机率,在城市化过程中,这些危险因素的快速增长以及缺乏筛查,可能会共同影响低收入国家转移性前列腺癌的发病率,正如在中国农村地区观察到的前列腺癌的发病率。然而,在亚洲人群中仍然缺乏设计良好的前瞻性队列研究,因此无法得出有关危险因素和量身定制的预防方法的明确结论。
目前支持前列腺癌筛查的证据通常基于早期PSA检测,根据ERSPC的数据,早期PSA检测可导致死亡率降低20%,但也与过度诊断和过度治疗的重大风险相关。从公共卫生的角度来看,关于我们是否应该建议在亚洲进行前列腺癌筛查,有几个方面需要考虑。首先,应根据MIR和转移性疾病的百分比作出决定,这表明前列腺癌诊断延迟,可以通过筛查加以改善。在日本,前列腺癌筛查已将转移性疾病的发病率从21.3%降低到11.6%,死亡率每年下降1.7%。第二,前列腺癌死亡率与前列腺癌筛查在癌症预防规划中的优先次序有关。在大多数亚洲人口中,最致命的癌症出现在呼吸和消化系统,前列腺癌通常不是五种最常见的恶性肿瘤之一,这意味着前列腺癌筛查不太可能作为一项国家筛查计划加以实施。最后,作为一个拥有许多发展中国家的大陆,必须仔细权衡筛查的经济负担和管理惰性疾病的相关治疗费用。在资源有限的地区,前列腺癌筛查也许可以纳入已建立的非传染性疾病监测系统。
在亚洲关于前列腺癌筛查的现有信息和风险-利益平衡筛查计划的发展之间存在着重大的认知差距。目前欧洲泌尿外科协会指南建议在筛选过程中应纳入5个要素,以减少过度筛查和过度治疗的危害:开始筛查年龄为45岁,以PSA 1 ng/ml为分类,血清PSA值为>1 ng/ml的男性每2-4年筛查一次;PSA值<1 ng/ml的男性每8年筛查一次。日本指南的起始筛查年龄较老(60岁),但筛查间隔较短(PSA >1 ng/ml每年筛查一次,PSA≤1 ng/ml每3年筛查一次)。60岁时血清PSA为1 ng/ml的预测价值可能与该年龄组男性中良性前列腺增生的高概率和高年龄特异性PSA水平有关。因此,与欧洲泌尿外科协会的建议相比,日本的指南可能不太可能减少低风险男性的过度筛查;需要前瞻性试验的证实性数据才能得出结论。基因组研究结果可以为具有发展侵袭性前列腺癌高风险的男性的筛查提供信息;例如,提倡对携带BRCA2种系突变的男性进行早期前列腺癌筛查。然而,癌症易感基因和患病率可能在不同祖先的男性中存在差异;因此,迫切需要对遗传数据进行专门的解释,以提高对这一变量的理解。
在亚洲应用PSA筛查的最有效方法是改进预测模型,并提倡对早期癌症进行积极监测。然而,在亚洲国家,积极监测仍未得到充分利用(2010-2012年,日本极低风险和低风险前列腺癌的发病率为18.2%,而2015年美国低风险前列腺癌的发病率为42.1%)。此外,活检预测模型通常高估了亚洲男性前列腺癌的风险。在香港接受前列腺活组织检查的男性中,ERSPC RC3模型将风险高估了10-40%。
新的生物标志物和多参数MRI扫描的使用改进了前列腺癌的诊断。分泌性生物标志物,如PSA和前列腺健康指数(PHI)具有鉴别价值,但没有在疑似患前列腺癌的亚洲男性中得到很好地校准(亚洲男性的癌症风险比使用相同鉴别方法的欧洲男性低20-30%)。这种差异可能是由于与用于开发生物标记物的西方国家的队列相比,亚洲人群的前列腺癌发病率非常低。ERSPC风险计算机制通常高估了东亚人群中前列腺癌的风险。因此,简单地概述西方人群中使用的诊断模型可能会在亚洲男性中产生较高的假阳性率;亚洲诊断生物标记的特异性诊断参考可以减少错误分类,提高亚洲男性临床显著前列腺癌检测的准确性。
此外,遗传背景的变异损害了欧洲血统衍生的遗传风险评分在亚洲人群前列腺癌诊断中的应用。在一项研究中,不到三分之一的欧洲衍生的与前列腺癌相关的SNPs在东亚男性中取得了显著的相关性。东亚地区(G132E和G135E)与西方地区(G84E)之间的HOXB13易感突变也存在差异。
最后,用于MRI扫描的前列腺成像报告和数据系统评分系统也显示了不同种族男性之间的不同表现,这可能会影响融合活检的结果和早期诊断。与其他种族的男性相比,使用前列腺成像报告和数据系统的亚裔美国男性发现的显著癌症明显较低(12% vs 21%,P=0.032)。因此,需要更多的研究来开发种族特异性的遗传风险评分和MRI评估模型。
前列腺癌的主要治疗方法是ADT,其疗效受患者睾酮代谢的影响。因此,某些药物基因组学因素,例如HSD3B1变异,可以影响ADT的疗效和随后的生存。东亚人群中HSD3B1不良等位基因率的降低可能解释了亚洲男性中与ADT相关的有利结果,并支持在人群水平考虑治疗偏好。相比之下,多西他赛或卡巴他赛等化疗药物的毒性作用可能受到体表面积或肌肉成分的影响。因此,在瘦人群(如亚洲男性比西方男性的比例更大)中可能会减弱此影响。
前列腺癌精准医疗的未来依赖于利用前列腺癌的6个主要药物通路:AR通路、PTEN-PI3K - AKT通路、DDR、细胞周期和谱系可塑性。虽然中国和西方的患者在局限性前列腺癌中有相似的致癌途径,但根据在中国男性中观察到的基因改变谱,应该采用不同的治疗方法。在异质性的亚洲人群中缺乏足够的基因组数据意味着在精确肿瘤学时代,治疗的差异似乎在扩大,随后,在西方人群中进行的早期临床试验增加了其他种族的男性参与这一快速变化的研究领域的难度。
揭示西方和亚洲男性之间流行病学和基因组差异的潜在原因,对于发展高质量的护理至关重要。为了构建亚洲男性的最佳早期癌症诊断模型,仍需要一项前瞻性前列腺癌筛查试验。为了减少过度筛查,试验必须以检测临床意义重大的癌症为目标,从而降低转移性疾病的发病率和总死亡率。这项研究将为校准现有的生物标志物提供机会,并开发亚洲特有的遗传风险评分和MRI分类系统。此外,该试验应将流行病学研究纳入致癌性机制和预防性干预措施,以了解揭露和预防怎样影响前列腺癌的发生。幸运的是,日本前列腺癌筛查前瞻性队列研究将在一定程度上回答这些问题,计划在2020年代进行并报告其首次分析。
人工智能技术可能为管理庞大人口和有限资源的困难提供一个重要的解决方案。前列腺癌的放射学和病理诊断是一个高强度的工作,在解释上有很高的观察者间的差异性,导致患者护理的损害。人工智能技术可以通过将医生的注意力集中在感兴趣的区域,减少工作量和观察者间的变化,并产生易于访问的诊断支持来促进患者的安全。
下一步是增加基因组分析在亚洲人群中的应用;尽管肺癌等流行癌症的基因组数据正在增长,但对于前列腺癌等发病率不断上升的癌症,这些数据仍处于起步阶段。由于公共数据库不能提供所有种族的完整信息,基因组理解方面的差距正在进一步扩大。尽管一些东亚研究小组使用GWAS检测前列腺癌中的常见变异,肿瘤组织的基因组分析很少在亚洲病人中使用,可能由于缺乏适当的存储的肿瘤组织和癌症之间的关系和人类发展指数的研究经费。数据库中亚洲基因组研究的代表性不足也破坏了基因组改变临床相关性的正确解释。因此,对亚洲患者和肿瘤亚型的研究将提高对癌症预后和治疗的认识。
最后,应该大力提倡在亚洲前列腺癌患者中进行临床试验。在全球范围内,亚洲患者参与各种临床试验的比例从1997年的0.25%逐渐增加到2014年的6%,这是一个逐步改善的过程,但仍然需要付出更多努力以代表多样化的亚洲人口。此外,亚洲公众传统上认为前列腺癌对公共健康的威胁不大。例如,2009年至2018年,在中国进行的1385项癌症试验中,前列腺癌试验仅占4%。相比之下,2020年全球前列腺癌死亡病例中近三分之一发生在亚洲。平等获得治疗取决于平等获得临床试验,这是第一步。对药物基因组学、治疗效果和毒性作用的研究将改善对不同种族背景的男性的治疗指导。此外,由于晚期前列腺癌的高比例,亚洲有机会加快病人登记参加系统治疗临床试验。
在亚洲不同地区和国家的前列腺癌的流行病学和基因组学中观察到相当大的异质性。不断增加的转移性疾病发病率和高负担是对公共卫生的挑战,亚洲和西方男性基因组学的种族多样性造成了治疗方面的不平等。需要制定早期预防策略、癌症筛查方案和特定种族的治疗方法,以弥合亚洲和西方男性对前列腺癌的理解和治疗之间的差距,并且迫切需要对种族多样性的优先问题进行研究。
复旦大学附属肿瘤医院主任医师,博士生导师
复旦大学附属肿瘤医院泌尿外科行政副主任
中国临床肿瘤学会前列腺癌专家委员会秘书长
上海市抗癌协会青年理事会副理事长
中国抗癌协会泌尿男生殖系肿瘤专委会精准学组副组长
2019年复旦大学青年五四奖章
2019年上海市卫健委青年五四奖章
2018年上海市“医苑新星”杰出青年医学人才
第七届复旦大学十大医务青年
第三批复旦大学卓学人才计划
2015年上海市青年科技启明星计划。
Prostate Cancer and Prostatic Disease编委
国家自然科学基金评审专家





 京公网安备 11010502033352号
京公网安备 11010502033352号