IMvigor130是一项三臂试验,A组:阿替利珠单抗+化疗(GP),B组:阿替利珠单抗单药组,C组:单独化疗(GP)。共同主要终点为RECIST 1.1 评估的PFS和OS(A组vs C组;ITT)以及OS(B组 vs C组;ITT,PD-L1 IC2/3)。次要终点包括安全性、ORR和DOR等,并按化疗类型进行OS探索性分析。既往的初步分析显示,Atezo+GP相较于GP作为一线mUC治疗,可显著改善患者PFS,但OS未达到统计学意义。此次AACR大会报告了IMvigor130研究第2次中期OS。
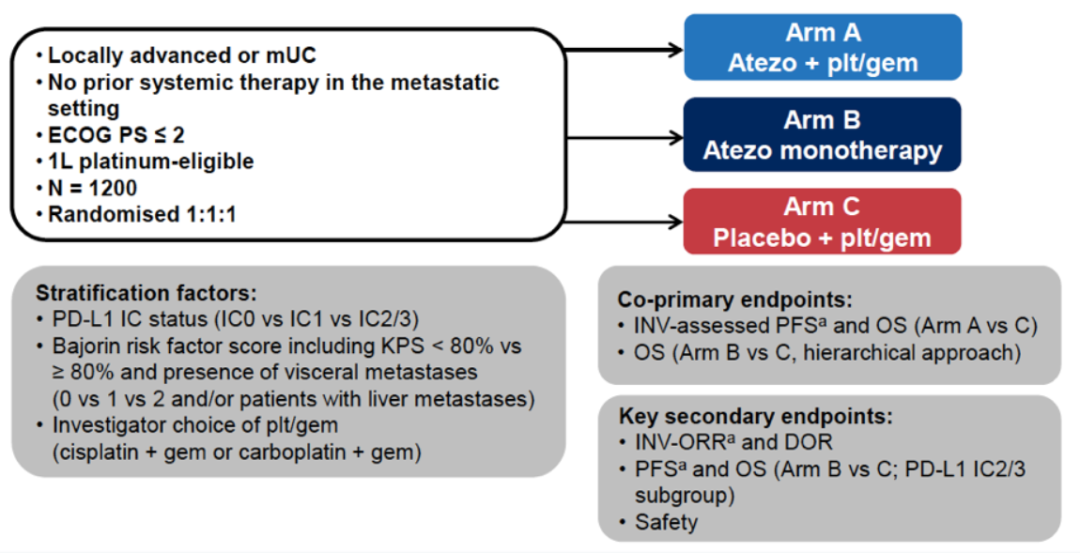
图1. IMvigor130研究设计
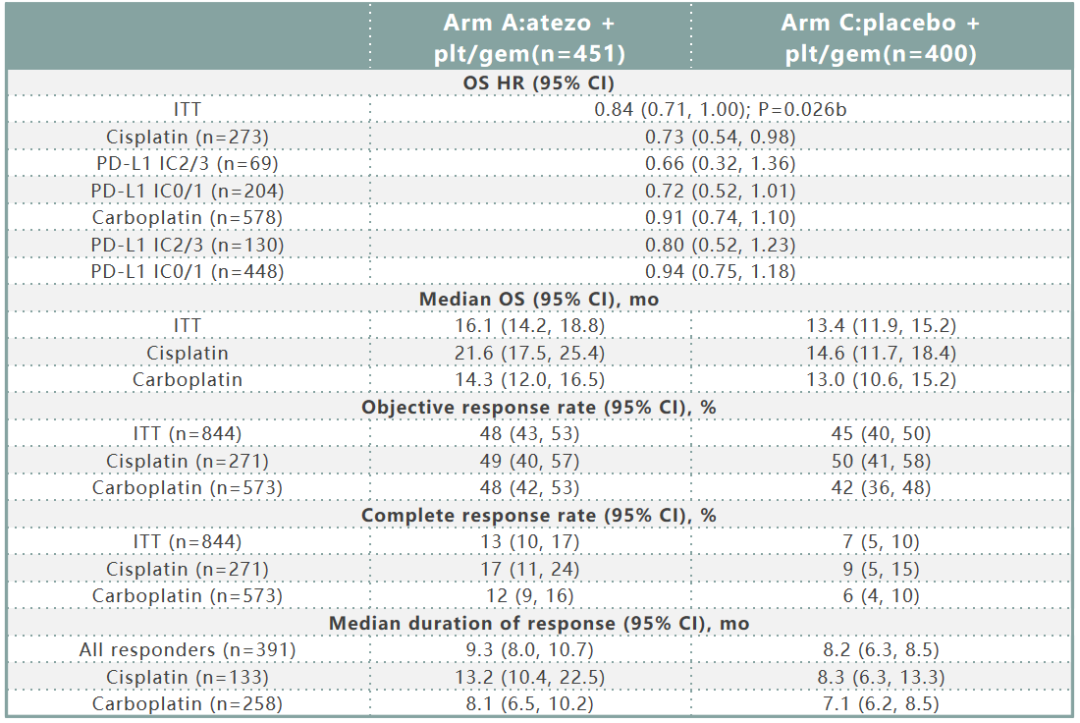
数据截至2020年6月14日(中位随访13.3个月),A组和C组OS事件发生率分别为67%和70%。A组和C组的疗效数据如表1所示。随后的非方案免疫治疗使用率A组为7%,C组为24%。在安全人群中(A组:454例;C组:389例),分别有81%和80%的患者出现3/4级治疗相关不良事件(TRAEs)。自第一次分析以来,没有出现新的5 级TRAEs(Gr 5 TRAEs:A组2%,C组1%)。A组和C组中3/4级特别关注的不良事件(AEIs)发生率分别为9%和4%。
表1. IMvigor130二次中期分析(A组 vs C组)
B组和C组的疗效数据如表2所示。探索性亚组分析表明,B组PD-L1 IC2/3患者的OS可能高于C组。在ITT患者中,C组的ORR较高,但B组的DOR中位数较长。在安全性方面,B组和C组的3/4级TRAEs发生率分别为16%和80%,5级不良事件率为1%。3/4级AEIs发生率分别为10%和4%,5级AEIs发生率<1%。
表2. IMvigor130二次中期分析(B组 vs C组)

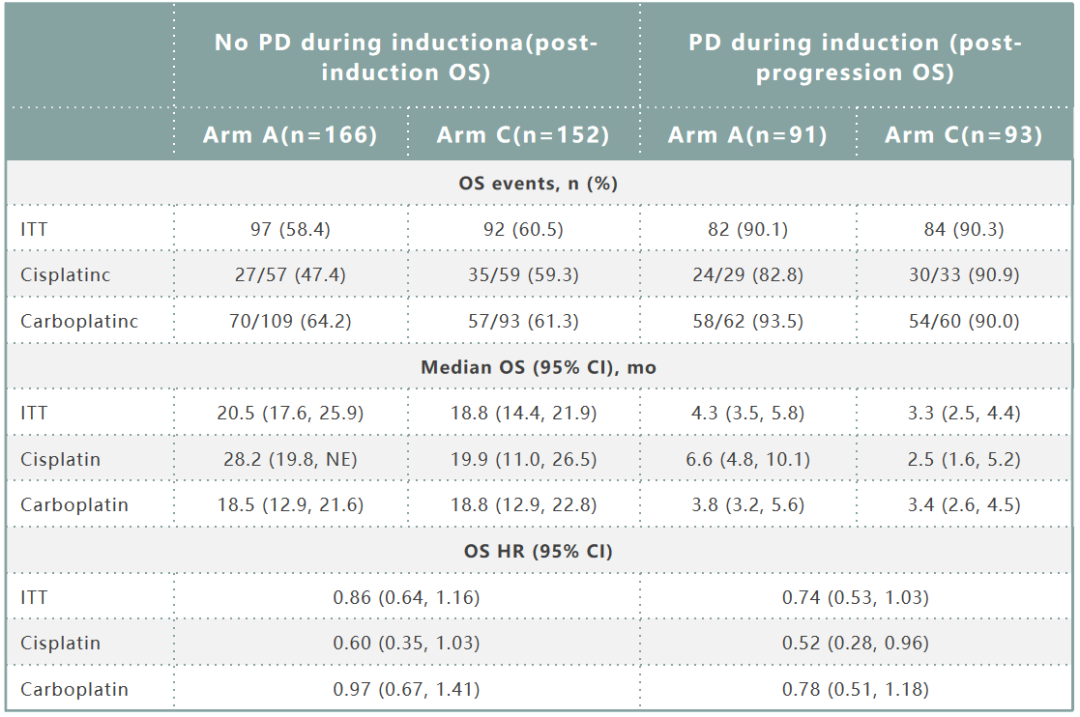
A组和C组按照化疗诱导期疾病进展情况进行分层的疗效数据如表3所示。诱导期无PD患者的OS HR为0.86(95%CI:0.64~1.16),其中顺铂方案HR为0.60(95%CI:0.35~1.03),卡铂方案HR为0.97(95%CI:0.67~1.41)。诱导期PD患者OS HR为0.74(95%CI:0.53~1.03),其中顺铂方案HR为0.52(95%CI:0.28~0.96),卡铂方案HR为0.78(95%CI:0.51~1.18)。
表3. A组和C组按诱导期进展情况进行分层的疗效
以PD-1/L1单抗代表的免疫治疗改变了晚期尿路上皮癌的临床实践,自2016年5月18日美国FDA批准阿替利珠单抗用于晚期尿路上皮癌的二线治疗以来,先后有更多PD-1/L1单抗获批,国内也于2020年开始先后批准了替雷利珠单抗、特瑞普利单抗用于晚期尿路上皮癌的治疗,使得晚期尿路上皮癌的治疗进入免疫治疗时代。
然而,PD-/L1单抗等治疗起效缓慢,作用温和等特点,决定了前移以及联合是其必然趋势。因此,近些年来,PD-1/L1单抗先后在前移与联合治疗方面进行许多尝试,分别在晚期尿路上皮癌化疗后的维持治疗、高危术后的辅助治疗以及非肌层浸润性尿路上皮癌的治疗不断取得突破,而在联合给药方面,包括PD-1/L1单抗联合铂类化疗以及联合CTLA-4单抗前移用于晚期尿路上皮癌的一线治疗开展了一系列随机对照临床研究,如IMvigor130、Keynote361、DANUBE、Checkmate901等研究,期望通过联合免疫治疗提高晚期尿路上皮癌的一线治疗疗效。
自2019年ESMO会议以来,先后有IMvigor130、Keynote361、DANUBE等研究公布结果,但令人失望的是,除了IMvigor130研究获得共同研究终点中位PFS时间的统计学微弱阳性外,其他两项研究均未获得成功。晚期尿路上皮癌一线免疫联合铂类化疗以及联合CTLA-4单抗的治疗策略未见成功,铂类化疗的一线治疗地位似乎难以撼动。而且由于IMvigor211、DANUBE等验证研究未能获得显著疗效,阿替利珠单抗与度伐利尤单抗也撤销了晚期尿路上皮癌二线治疗适应症。因此,对于唯一获得共同研究终点PFS阳性的IMvigor130研究的长期随访另外一个共同研究终点OS是否能够获得统计学差异更加令人关注。
今年AACR会议报告了IMviogr130研究的第2次生存随访,结果显示与第一次数据分析保持一致,免疫联合组与化疗单药组的中位OS分别为16.1与13.4个月,HR=0.84(95%CI:0.71~1.00,P=0.026),但仍未达到研究规定的统计显著性,且无论诱导期是否发生PD,但顺铂加入阿替利珠单抗似乎比卡铂加入阿替利珠单抗获益更显著;而在阿替利珠单抗单药治疗组与铂类单药化疗比较中,PD-L1高表达人群似乎更能从免疫治疗中获益,特别是铂类不能耐受人群。因此对于晚期尿路上皮癌一线免疫联合化疗仍然不能代替传统的铂类化疗,而对于铂类不能耐受人群,特别是其中PD-L1高表达的患者,一线接受单药免疫治疗是获益的。
结合KEYNOTE361研究,对于晚期尿路上皮癌的一线治疗,铂类化疗不再适合与PD-1/L1单抗联合给药,近年来抗体偶联药物异军突起,2020年ASCO-GU公布了EV联合帕博利珠单抗用于不能耐受铂类化疗人群一线治疗取得突破性疗效后,免疫联合抗体偶联药物用于晚期尿路上皮癌的一线治疗被寄予厚望,目前已经在开展全球的3期随机对照临床研究,而国内也在尝试特瑞普利单抗与抗体偶联药物RC48用于晚期尿路上皮癌的治疗,这些结果或许可能改变晚期尿路上皮癌的临床实践。





 京公网安备 11010502033352号
京公网安备 11010502033352号