2020年8月5日,“遇见PI”第三场网络直播会议特邀ATEMPT研究全球Leading PI、美国Dana-Farber癌症研究所Sara M.Tolaney教授介绍早期HER2+乳腺癌的治疗方法,对相关临床研究做深入解读,会议还邀请了重庆医科大学附属第一医院厉红元教授、河南省肿瘤医院刘真真教授带领国内多位知名专家结合临床实际案例进行了探讨与分析,就乳腺癌原发小肿瘤和残存小肿瘤的治疗策略进行深入的讨论交流。
早期HER2+乳腺癌的治疗方法——Sara M.Tolaney教授

众所周知,曲妥珠单抗为HER2阳性乳腺癌患者带来了革命性的进步。虽然有了曲妥珠单抗的治疗,仍有25%的患者在10年间出现复发,这就需要我们能进一步进行个体化治疗的策略设计。至此,我们需要一些标志物来提示我们,哪些患者需要降阶梯治疗,哪些高危患者需要升阶梯治疗。
Meta分析显示,蒽环类药物有增加心脏毒性的风险。在BCIRG006研究中,经过10.3年的随访发现,含曲妥珠单抗1年的方案使得HER2阳性早期乳腺癌辅助治疗取得持续生存获益,AC-TH和TCH组患者DFS的获益趋于一致,并且TCH组相对于含蒽环的AC-TH组,所有心脏不良事件大幅减少,是一个心脏安全性更好的方案。在今年ASCO上公布的TRAIN-2研究提示,使用紫杉烷替代蒽环类药物,心脏毒性显著减少。BCIRG006和TRAIN-2研究证明,以紫杉烷为基础的治疗与以蒽环类药物为基础的治疗后长期结局相似,即使在高风险淋巴结阳性患者中也是如此,但紫杉烷组减少心脏毒性反应和白血球过多症,因此难以证明HER2靶向治疗中应用蒽环类药物的合理性。
KAITLIN研究中我们可以看到,在3-4个周期的蒽环类为基础化疗后,对比序贯接受紫杉类化疗3-4个周期+18个周期PH方案(AC-THP),序贯18个周期T-DM1+帕妥珠单抗治疗(AC-KP)方案未降低IDFS事件的风险,淋巴结阳性人群中结果一致。从患者报告结局中看到,AC-KP组整体的生活质量在治疗组下降是更加缓慢的,AC-KP组在QOL方面有着更好的表现,这也展示T-DM1在乳腺癌中是非常好的一个药物,它非常好的减缓了生活质量的下降。
KRISTINE研究主要对比了TCHP vs T-DM1+P,我们发现与TCHP方案相比,T-DM1 + P方案治疗可减少毒性发生,TCH+P组 vs T-DM1+P组3年iDFS(排除新辅助治疗期间出现进展的患者)取得相似结果 (93% vs 92%)。
所以,T-DM1(+ P)可能是TCHP的合理替代治疗方案。尽管KAITLIN研究未达到主要终点,但两组的结局相似(尽管该研究并非采用非劣效性设计),并且高风险患者的3年iDFS率极佳(> 90%)。
既往研究发现,I期HER2 +乳腺癌的5年复发风险大约在10%-30%之间。我们设计了APT临床试验,入组了HER2+,ER+或 ER-淋巴结阴性,肿瘤≤3cm的患者,紫杉醇 80 mg/m2 + 曲妥珠单抗 2 mg/kg x 12,序贯曲妥珠单抗(6 mg/kg),每3周一次给药13次。7年DFS是93.3%,7年RFI达97.5%,被记录的不良反应事件很少。只有2例(0.5%)患者出现有症状的充血性心脏衰竭,曲妥珠单抗停药后这两例不良事件缓解。左心室射血分数无症状下降在13例(3.2%)患者中被观察到,11例患者在曲妥珠单抗停药后恢复正常。
我们希望对于I期HER2+乳腺癌患者能有毒性更小的方案,所以ATEMPT研究诞生了。ATEMPT研究是一项研究者发起的随机多中心、Ⅱ期辅助治疗研究,对比了T-DM1和TH方案。主要研究终点是评估T-DM1组的3年无病生存率(DFS)和比较两组间有临床意义的毒性(CRT)发生率。临床有意义的毒性包括:≥3度非血液学毒性,≥2度中枢神经系统毒性和≥4度血液学毒性,中性粒细胞减少发热,以及任何需要进行剂量延迟或中断的毒性。
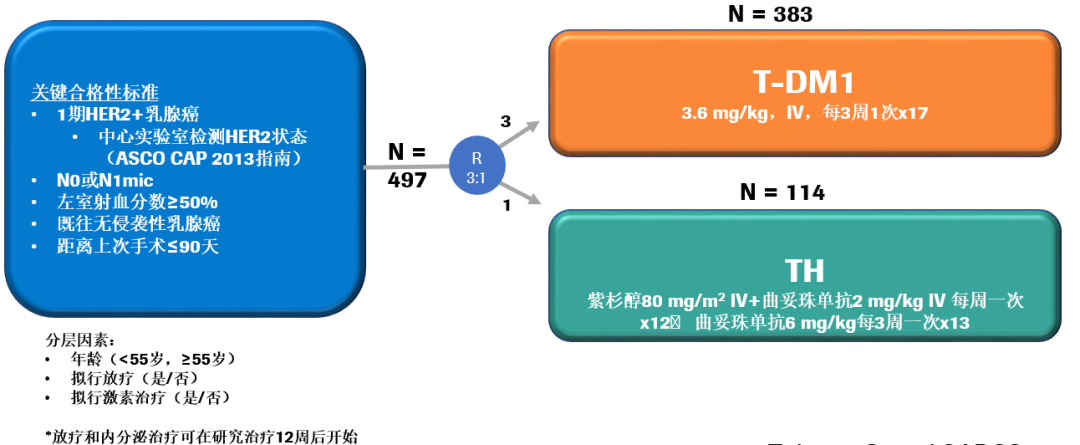
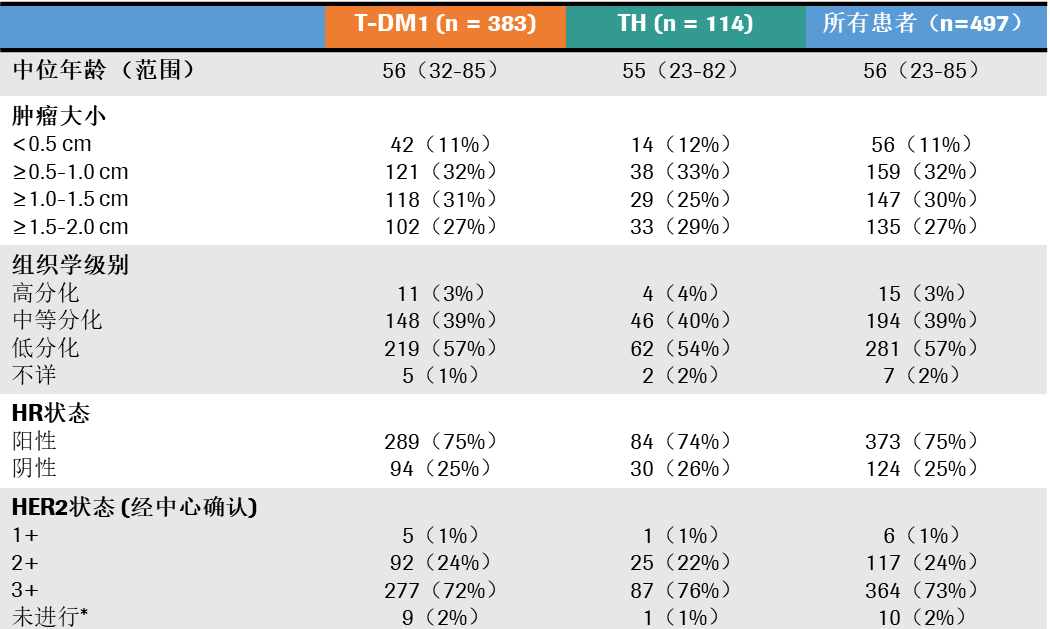
基线特征:研究共入组了512例HER2+患者,497例研究方案治疗,其中T-DM1组和TH组分别为383例和114例。基线特征分析显示,T<0.5cm的患者占11%;T≥0.5-1.0cm的患者占32%;T≥1.0-1.5cm和T≥1.5-2.0cm的患者分别占30%和27%。73%的患者为HR+肿瘤。
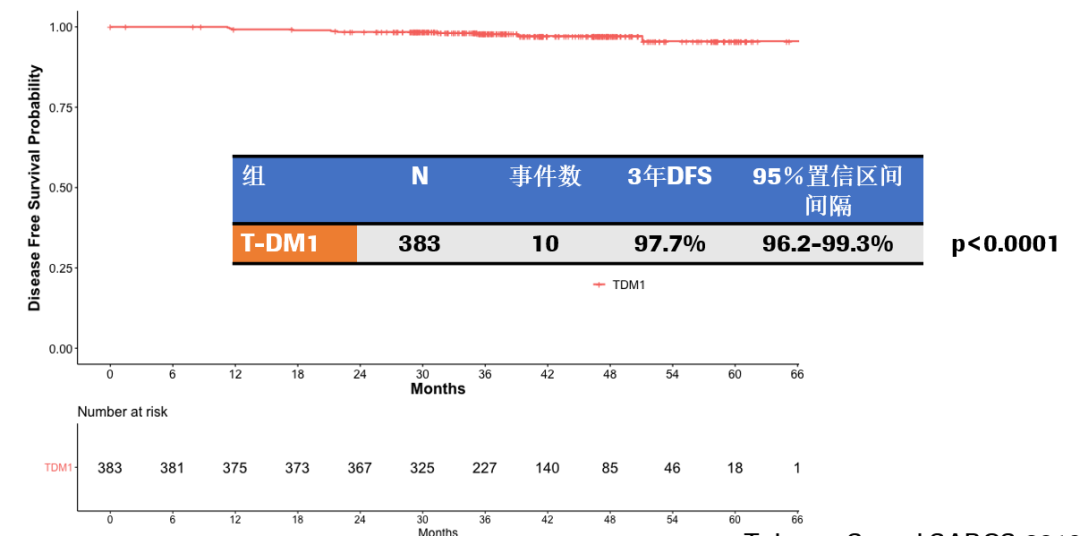
研究发现:中位随访3年后,T-DM1组共出现10个DFS事件,3年DFS率为97.7%(95%CI:96.2%~99.3%)。
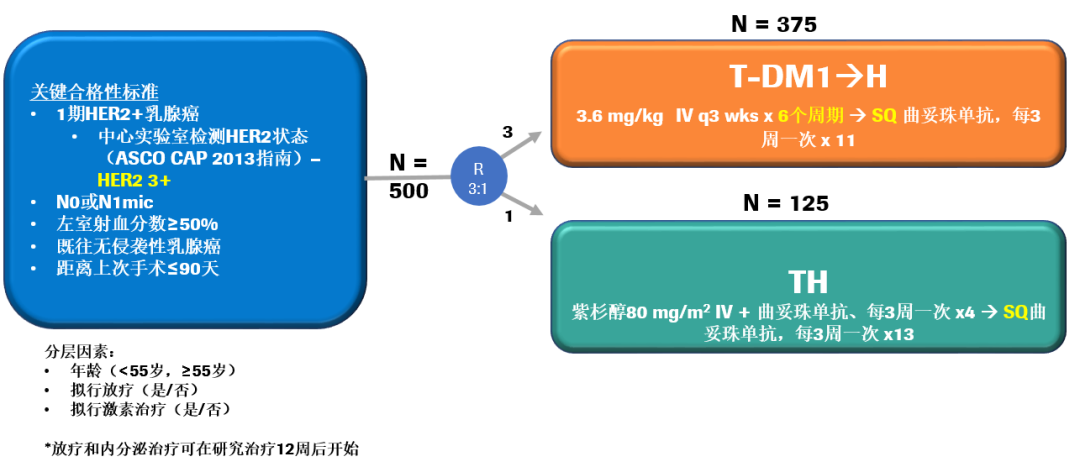
安全性分析:T-DM1组和TH组中,临床有意义的毒性发生率均为46%。两组在≥3度非血液学毒性,≥4度血液学毒性、粒缺性发热、任意需要进行剂量延迟的毒性发生率上相当。T-DM1组≥2度中性粒细胞减少的发生率低于TH组(11% vs 23%);而T-DM1组的任意需要提前终止治疗的毒性发生率高于TH组(17% vs 6%)。

患者报告结局显示,使用紫杉醇联合曲妥珠单抗组vs T-DM1组生活质量大幅下降,并且有更多的脱发困扰,影响日常生活和工作。另外,在基线绝经前期患者中,随访18个月时:47%接受TH治疗的女性报告过去6个月中出现至少一次月经;75%接受T-DM1治疗的女性报告过去6个月中出现至少一次月经(p = 0.045;Fisher精确检验)。所以在对月经的影响方面,T-DM1组有一定的优势。
所以,哪些I期HER2 +疾病患者应接受T-DM1治疗?I期HER2 +疾病患者在接受1年T-DM1治疗后极少出现复发,3年DFS率 97.7%(95%CI:96.2-99.3),RFI 99.1%(95%CI:98.1-100),与TH方案相比,T-DM1方案治疗使有临床意义的毒性发生率显著降低;T-DM1组与TH组间有临床意义的毒性(CRT)事件无任何差异;但两组间毒性特征存在差异,CRT终点并非包括所有毒性,包括脱发,并且在评估耐受性时应考虑患者自报结局(PRO)(通常支持T-DM1方案),鉴于该试验中事件发生率低,因此T-DM1可能是TH的替代方案。
为评估T-DM1的用量是否可以减少,我们又计划开展ATEMPT2.0研究,6周期的T-DM1序贯皮下曲妥珠单抗,或直接TH方案,比较两组之间的毒性。
多项研究和meta分析显示,1年曲妥珠单抗治疗仍是标准治疗疗程,(低风险疾病患者因毒性提前停止治疗不会对其预后产生重大影响)。
APHINITY试验:一项III期辅助治疗研究,评估在曲妥珠单抗+化疗基础上加用帕妥珠单抗的益处,IDFS(ITT人群)74.1个月中位随访结果显示,双靶辅助治疗组IDFS绝对获益达到2.8%,复发风险进一步降低达到24%。
添加来那替尼治疗?ExteNET研究,对于曲妥珠单抗+化疗辅助治疗的早期HER2阳性乳腺癌患者,序贯来那替尼1年治疗对比安慰剂组,5年iDFS率分析相对安慰剂组有2.5%的提升。并且,激素受体(HR)阳性,即“三阳性”乳腺癌患者从来那替尼的延长抗HER2辅助治疗中获益更为显著。但研究中有30%-40%的患者发生3/4级腹泻,所以我们需要预防和减少腹泻的发生。目前存在的挑战是既往接受过帕妥珠单抗和/或T-DM1治疗患者的数据缺乏,还必须权衡毒性(约40%患者发生3/4级腹泻)与潜在获益,所有患者均应接受腹泻预防用药(或可以考虑采用剂量递增方法)。
KATHERINE研究,用T-DM1替代曲妥珠单抗,T-DM1可以帮助non-pCR的患者减少疾病复发。
KATHERINE研究给我们带来了一些启示:
T-DM1引领HER2阳性早期乳腺癌治疗模式变革:KATHERINE研究分析,新辅助使用含H方案治疗后non-pCR患者选择T-DM1治疗3年iDFS绝对获益提高11.3%,这个获益是革命性的,就像当年赫赛汀的出现大大超过了单纯化疗时代带来的获益。是目前唯一有循证证据的non-pCR患者的治疗方案。
T-DM1与HP方案治疗后患者预后是否相同?约20%的患者接受了双联HER2治疗,并得到了一致的获益。因此HP双靶新辅助治疗后non-pCR患者首选T-DM1治疗。
T-DM1的最佳治疗持续时间是多久?约71%的患者完成了所有14个周期治疗(18%的患者因AE停药;术前接受AC与未接受AC治疗的患者停药率相似),需开展进一步研究以对此进行评估。
当然KATHERINE研究也给我们带来了一些思考:
如果T1c肿瘤患者存在残留病变,他们是否会从T-DM1辅助治疗中获益?6/32名接受曲妥珠单抗治疗的患者出现复发,而0/45名接受T-DM1治疗的患者出现复发。总体而言,小样本的人群中事件发生率较低,T-DM1的疗效似乎得以维持。
患有不可手术疾病或术前治疗前淋巴结阳性的患者即使达到pCR,是否也应接受T-DM1治疗?GBG数据表明,这些患者仍具有显著的复发风险,需进行进一步研究以了解这一患者人群中的获益。
手术时肿瘤转化为HER2阴性的患者是否能够从T-DM1治疗中获益?发生率高达15-30%
在70名手术时HER2转阴或低表达的患者中,随机化至T-DM1组的患者(n=28)未发生IDFS事件,而随机化至曲妥珠单抗组的患者(n=42)发生了11例IDFS事件。
KATHERINE研究中患者预后是否改善?N+患者的3年 iDFS:83%,CNS复发率未改善,未来研究可能需要考虑采取进一步升阶梯治疗策略:
最后我们再来回顾一下当前HER2阳性乳腺癌的治疗方法:
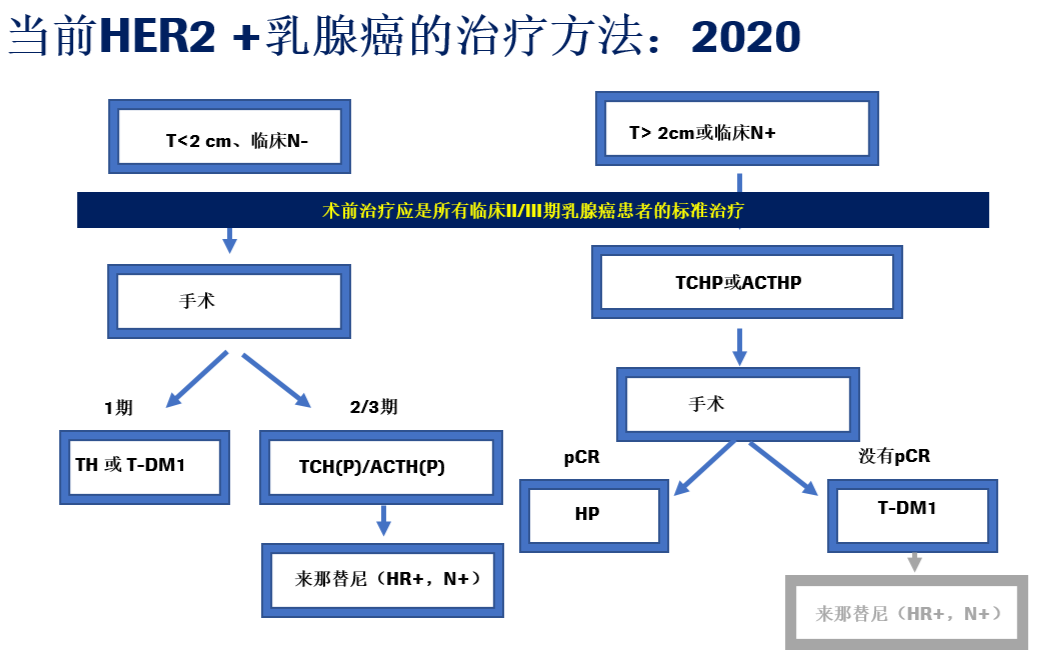
总结:目前我们已经能够通过对新辅助治疗的应答结果来指导术后辅助治疗方案的选择,从而改善长期的治疗结局,这代表HER2+乳腺癌治疗的一种模式转变,重要的是,所有HER2+肿瘤>2 cm或临床淋巴结阳性的患者均应接受以曲妥珠单抗和帕妥珠单抗为基础的新辅助治疗,所有未达到pCR的患者均应接受T-DM1辅助治疗。延长1年来那替尼辅助治疗可以使某些患者获益,尤其是那些具有高复发风险的HR+疾病患者。I期HER2+乳腺癌患者可以接受TH或T-DM1辅助治疗,未来研究将重点关注升阶梯和降阶梯治疗策略。
陈秀春教授:HER2+阳性乳腺癌优选靶向抗HER2治疗,在单靶时代,我们已经有一个降阶梯化疗的尝试,在双靶及T-DM1时代,ATEMPT研究给我们启示,T-DM1组3年iDFS有明显的获益,并且毒副作用明显下降,生活质量明显提高,虽然停药率有一些高,我注意到后续还有ATEMPT2.0的研究,期待6周期T-DM1序贯H的治疗能给患者带来获益。
樊菁教授:我想请教Tolaney教授临床治疗相关的问题。我有两个患者,患者1,年轻女性,肿瘤2cm,淋巴结阳性,N1分期,想行保乳手术,新辅助化疗+曲妥珠单抗+帕妥珠单抗治疗4周期后超声提示肿瘤缩小,达到了SD,然后我又给她做了一次活检,病理报告提示没有肿瘤细胞,下一步应该如何治疗?患者2,分期为T3N2M0,用了化疗联合赫帕双靶6周期后进行了手术,病理结果显示达到了pCR。回顾该患者病史信息时,发现她化疗时用的多西他赛是低于标准剂量的,虽然达到了pCR,但其后续治疗应如何开展呢?
Sara M.Tolaney教授:标准治疗方案应该是6周,但活检提示肿瘤已经不是活性肿瘤了,这时很难判断,因为也许活检只取到了肿瘤的一部分。这时候需要考虑前四个周期患者的耐受如何,耐受好的话我会建议继续完成后2个周期的治疗,完成6周期治疗后手术,辅助治疗阶段需要继续使用妥妥双靶方案。我觉得患者2后续的治疗应该继续使用妥妥双靶,这也是我经常遇到的问题,基线风险很高,虽然她们达到了pCR,但她们后续复发的风险还是很高的,但目前还没有相关的数据表明,T-DM1可以使这部分患者减少复发,所以目前还不建议用T-DM1,建议继续使用HP的治疗。
李凡教授:目前治疗的趋势是靶向治疗的升阶和化疗的降阶,升阶主要是单靶→双靶甚至non-PCR的患者应用T-DM1强化,降阶梯主要是去蒽环。APT研究、ATEMPT研究等,用T-DM1代替TH方案,考虑到经济性的问题,我想问,在美国是如何用T-DM1代替TH方案的?
Sara M.Tolaney教授:在美国T-DM1价格也是TH方案价格的两倍,我们需要平衡经济成本和毒性事件,T-DM1会有更好的生活质量,这需要与病人有更好的探讨,在美国T-DM1还没有通过FDA批准用于I期的患者,保险公司目前也不能报销,所以目前还是需要和患者去探讨这个方案,当患者有神经毒性困扰的话,可以考虑使用T-DM1的治疗。
乔江华教授:随着T-DM1的问世,重新定义了HER2阳性乳腺癌的治疗策略,也为目前的治疗策略带来了很多探讨。但从现有的证据来看,仅从KATHERINE研究中看出,T-DM1在non-pCR患者的强化辅助治疗显示出优势,但在新辅助治疗阶段等,还是没有显示出强于目前TCHP的方案的,辅助治疗中,也没有获得很好的结果,所以我们需要重新思考,除了non-pCR的患者,还有哪些患者需要接受T-DM1的治疗,或许I期小肿瘤是一个很好的探索方向,但也需要平衡药物毒性问题,另外PET评估以及是否缩短疗程来降低毒性等都是未来的一个主要研究方向。
患者,女,39岁,主诉:因“右乳皮肤红肿1月”于6月前入院,查体,右乳橘皮样改变,累积外上、外下象限,外上象限质韧肿块6*5cm,右腋下融合淋巴结4*3cm,锁骨上淋巴结1.5*1cm,超声和MRI结果和查体吻合,穿刺病理结果:右乳非特殊类型浸润性癌,ER-,PR-,HER2 +++,细胞学右腋及锁骨上淋巴结见癌细胞,符合转移。全身检查,未见转移征象。
诊断:右乳炎性乳癌,cT4dN3M0,IIIC期,HR阴性/HER2阳性型
问题一:后续治疗如何选择?根据CSCO指南的推荐,我们首先考虑新辅助治疗。
问题二:新辅助治疗方案如何选择?目前的优选方案主要有三种,TCbHP、THP或TCHP、AC-THP。最后该患者选择了TcbHP方案新辅助治疗6周期,评价PR,改良根治术,术后病理提示:ypT1ypN0(Miller-Payne 4级),non-PCR。
问题三,non-PCR MP4级的患者应选择何种治疗方案?根据KATHERINE研究,我们最终选择了T-DM1治疗+局部放疗,目前没有太多的毒副反应,血小板尚可。
樊菁教授:这个病例的治疗相对来说还是比较成功的,新辅助治疗后有挺好的效果,我有一个小问题,这个患者在基线评估的时候,锁骨上淋巴结是有转移的,在新辅助治疗后锁骨上淋巴结看不见了,手术中锁骨上淋巴结是否有处理?
刘世伟教授:锁骨上淋巴结我们手术中没有处理,选择了放疗。
樊菁教授:这一点上我稍微有一些不同的观点,我们一般可能考虑更多的是放疗的效果,但很少会考虑到放疗的副作用,我记得之前看过瑞金医院放疗科发过的一篇文章,结果显示锁骨上的放疗是能够满足临床需要的,但同时对于周围组织的创伤还是较大的,所以我个人觉得如果这个人手术中不如直接切除这个锁骨上淋巴结,做一个病理,是否会更好?这是我个人的一些观点。
李凡教授:按照指南和我自己的临床经验,我也会优先选择TcbPH方案,达到pCR的概率会更高一些。
刘明阁教授:首先我想谈一下炎性乳癌,实际上这个类型在临床上还是比较少见的,临床上会出现红肿、触痛的表现,病理上会出现真皮层淋巴管和脉管癌栓,除此之外,还有一些其他的特征,比如大多数病例呈现出较高的组织学分级、淋巴结转移、ER、PR阴性、HER2阳性的表达,所以炎性乳癌是一类高侵袭性的预后较差的乳腺癌类型。其次,对于新辅助治疗后的病理评估,现在国内常用的是MP分级系统,国际上大多上用的是RCB的评估系统,最大的差异是对PCR的定义不同,所以我们国内统一的标准都规定了,原发灶没有浸润性癌成分以及淋巴结和脉管内没有癌成分,所以这一点上我们保持了一致。但两种评价系统之间还是有一些差异性的。
Sara M.Tolaney教授:我也会考虑TcbHP方案,因为该方案的pCR率会达到60%,对于该患者的后续治疗,我们也会考虑T-DM1治疗。根据KATHERINE研究的数据,我个人还是倾向T-DM1治疗,尽管大家可能会有担忧,患者因为毒副作用而停药,但我们可以看到T-DM1可以降低50%的复发风险,我认为如果患者因毒副作用而停药了,可以再用双靶继续进行后续的治疗。
对于T-DM1安全性问题,“放心莱”患者福利保险数据显示:中国患者使用T-DM1持续治疗比例为94%,用药剂量调整的患者比例为10%,患者治疗依从性良好,安全性可控。
李凡教授:患者女,52岁,主诉:左乳包块28年,进行性增大3年。查体左乳头内陷,上方扪及巨大包块,10*10cm,明显隆起,质硬,边界欠清,形状不规则,固定。双侧腋窝及锁骨上均未扪及肿大淋巴结。影像学检查与查体吻合。穿刺结果显示:左乳浸润性癌,非特殊类型,III级8分,免疫组化:ER-,PR-,Cerb8-2+++,p53 80%(3+),ki67 30%(+)。
诊断:左乳浸润性癌,非特殊类型 cT3N0M0,HER2过表达。
该患者入组临床试验:多西他赛+卡铂+SIBP-01/赫赛汀 q3w*6 cycles。疗效评估,MRI基线:79*69mm,第二周期后53*40mm,PR,第四周期后58*39mm,SD,第六周期后69*62*37mm,PD。全身无转移征象。
手术治疗:左乳癌改良根治术。术后病理:肿块7*5*4cm,III级8分,MP1级,腋窝淋巴结2/12。
术后予放疗+T-DM1治疗。
1.对于术前仅使用曲妥珠单抗单靶治疗的患者,术后靶向治疗的选择:T-DM1 or HP?
2.对于该患者新辅助治疗过程中,是否考虑调整化疗方案或提前手术?
3.如该患者手术后没有用T-DM1,后续是否必要加用其他化疗方案?
4.如该患者在使用T-DM1治疗过程中出现不良反应停药,后续治疗方案及疗程?
5.基因检测对于该患者的价值?
甘露教授:这个患者如果不是进临床试验的话,新辅助治疗还是考虑双靶治疗。但这个患者选择了单靶治疗,效果并不是很好,如果考虑换化疗方案,也有失去手术机会的风险,这是一个两难的选择。对于后续的治疗,从循证医学来说选择T-DM1是正确的。对于基因检测,可以考虑做一个,是不是有什么原因引起的了赫赛汀的耐药,如果有相关的突变,可能会对后续的治疗有一定的指导意义。
陈秀春教授:这个患者我认为新辅助还是应该优选双靶治疗,在4个周期效果不太好的时候,我们可能会考虑MDT会诊后更改治疗方案。这个患者的疗效评价并不是很好,不知道这个临床试验是否可以让该患者出组,进行更好的治疗。术后的治疗方案选择T-DM1是没有争议的。另外,即使术后达到pCR MP5级的患者,虽然术前用了单靶治疗,术后我依然会选择双靶的治疗方案。
齐晓伟教授:该患者对于单靶治疗其实是一个耐药的情况,根据KATHERINE的证据,该患者术后应该使用T-DM1治疗。从另一个角度来看,患者术前单靶治疗是MP1级,所以我认为可能该患者双靶的治疗效果也不会太好,有可能她对于胞外段的抗体有耐药,建议进行一个多基因检测,看是什么原因导致她对单抗类的药物产生了耐药。我想问Tolaney教授一个问题,PIK3CA的突变与抗HER2治疗的耐药是否相关?
Sara M.Tolaney教授:我认为PI3K的突变有时候是有一些混淆性的,它和预后及患者结局的预测有一些相关性。比如Cleopatra研究中,PI3K突变和患者预后有一定的关系,但其实它只是判断预后的其中一个因素,我们对于PI3K的了解还不是很充分。当然KATHERINE研究中的PI3K突变不能判断T-DM1的耐药性,也不能帮我们判断患者能否获益,而且这个检测是基于术中的样本,所以您的建议非常好,我们是否应该取一个术前基线的样本,更好帮助我们去判断。所以对于患者是否能够通过PI3K判断预后及耐药,其实还有一些其他驱动基因突变也可以导致抗HER2靶向治疗的耐药,这方面没有充分的数据,所以我们目前还是只能根据患者术后残余病灶来判断后续是否使用T-DM1的治疗,而PI3K突变目前还不是很好的指标帮我们判断患者使用T-DM1是否会有好的获益。
周绍强教授:在新辅助治疗时,如果肿瘤进一步进展了,是应该选择手术,还是更换化疗药物?我想继续请教Tolaney教授这个问题。
Sara M.Tolaney教授:这是非常好的一个问题,术前用了抗HER2的药物后有一个进展,我们该如何选择治疗方案?这需要结合患者的情况看:肿瘤是否可以切除、新辅助治疗的周期以及治疗方案。我们要确保患者可手术的机会,不要让她错过了手术的窗口期,另外我们还要看她的治疗方案,如果患者是4个周期时,我可能会换成蒽环类的方案,我会综合考虑患者的情况。
欧江华教授:我认为这个患者新辅助治疗是符合双靶治疗条件的,我提倡TcbHP方案,另外对于抗HER2治疗耐药性的问题,你们是否会检测p95、PI3K等基因突变?
Sara M.Tolaney教授:我们其实没有在做基因组学的分析,关于病人为什么会出现耐药的情况,这样的病人还是比较罕见的,其实我们患者基本会根据HER2阳性或阴性表达来作为筛选,所以这可能是一个不错的科研话题,但目前可能只有1-2%的患者会出现原发性的Her2耐药,我们很少去做的。
欧江华教授:那您是否会考虑TKI的治疗?或者考虑三靶联合治疗(曲妥珠单抗+帕妥珠单抗+TKI)?
Sara M.Tolaney教授:这是一个很有意思的问题,目前我们没有这方面的数据,我们可能更多的需要考虑三靶联合的毒性问题,目前有一些临床试验正在开展,但目前还没有这样使用的证据。





 京公网安备 11010502033352号
京公网安备 11010502033352号