编者按:在21号举办的ASCO-GI食管和胃癌口头报告专场中,大会选取了5篇重要研究做重点介绍,肿瘤瞭望记者将内容整理如下,供大家交流学习。
奥沙利铂/卡培他滨或紫杉醇/卡铂为基础的化放疗作为可切除食管腺癌术前方案效果良好
摘要3:NEOSCOPE:评估诱导化疗之后给予奥沙利铂/卡培他滨或紫杉醇/卡铂为基础的化放疗作为可切除食管腺癌术前方案的随机II期临床试验。
背景:NEOSCOPE试验比较2种术前CRT方案的疗效和安全性。
方法:筛选可切除的≥T3和/或≥N1的食管腺癌患者,1:1随机分配至OXCAP-CRT组(奥沙利铂85 mg/m2 ,1、15、29天;卡培他滨625 mg/m2,一天两次,放疗期间)或CarPac-CRT(卡铂AUC2;紫杉醇50 mg/m2 ,1、8、15、22、29天);同时化疗方案为: 45 Gy / 25次/ 5周。两组均给予诱导化疗:OXCAP(奥沙利铂130 mg/m2 D1,卡培他滨625 mg/m2 D1-21,每3周重复)2个周期。放化疗6-8周后给予手术治疗。主要研究终点:完全病理缓解(PCR)。次要研究终点:安全性、手术并发症/死亡率,R1率,OS。统计学:pCR达35%可进行下一步研究。共入组85名患者,(允许10%的失访)。76例(38 / 组)患者任何一组pCR≥10例则可考虑进入III期研究。
结果:2013年10月和2015年2月之间共招募了85例来自英国17个研究中心的患者。患者平均年龄65岁,男性(81%),WHO PS评分为0占85%。肿瘤基线特征:T3(86%),N 1(48%),T3以下(90%),肿瘤平均长5.8 mm。 放化疗期间两组出现CTCAE 3/4级毒性反应率为OXCAP-CRT 42.1%,CarPac-CRT 52.4%(P = 0.358)。两组完成规定放疗量分别为OXCAP-CRT 90.5%,CarPac-CRT 93%。
结论:两种术前放化疗方案均耐受性良好。 CarPac-CRT组满足条件进入III期研究,而OXCAP-RT组没有。
(试验号:NCT01843829,威尔士癌症试验中心协作)
zv-aflibercept不能显著改善FOLFOX在转移性腺癌食管中的功效
摘要4:评估FOLFOX联合zv -aflibercept /安慰剂治疗未接受过化疗的转移性腺癌食管(MEGA)患者的多中心双盲随机II期临床试验。
背景:FOLFOX在MEGA RR为 53%,PFS为6.8个月(CALGB 80403)。血管内皮生长因子(VEGF)抑制剂在一些随机试验中能改善部分MEGA患者的生存。zv-aflibercept能够结合VEGF-、B和PlGF,提高难治性转移性结直肠癌患者的生存率。
方法:所有患者接受mFOLFOX6, 每14天一周期。2:1随机分配至A组:zv-aflibercept 4 mg /kg/ D1或B组:安慰剂。每8周做一次评估。主要终点:6个月 PFS。
结果:2013年1月 - 2015年4月共入选64例患者,性别比例:55 男性/ 9女性;年龄段(中位数):32-83(62); ECOG PS 0/1/2:33/28/3;原发肿瘤:食管26 / 胃食管结合部 18/胃20;可测量/可评价:52/12例;转移:淋巴结 48例、肝25例 、肺15例、其他共12例,包括肾上腺4 例、骨3例。64例患者中:34例可评估1年OS,9例因毒性反应退出,4例死亡,3例退出试验(见下表)。
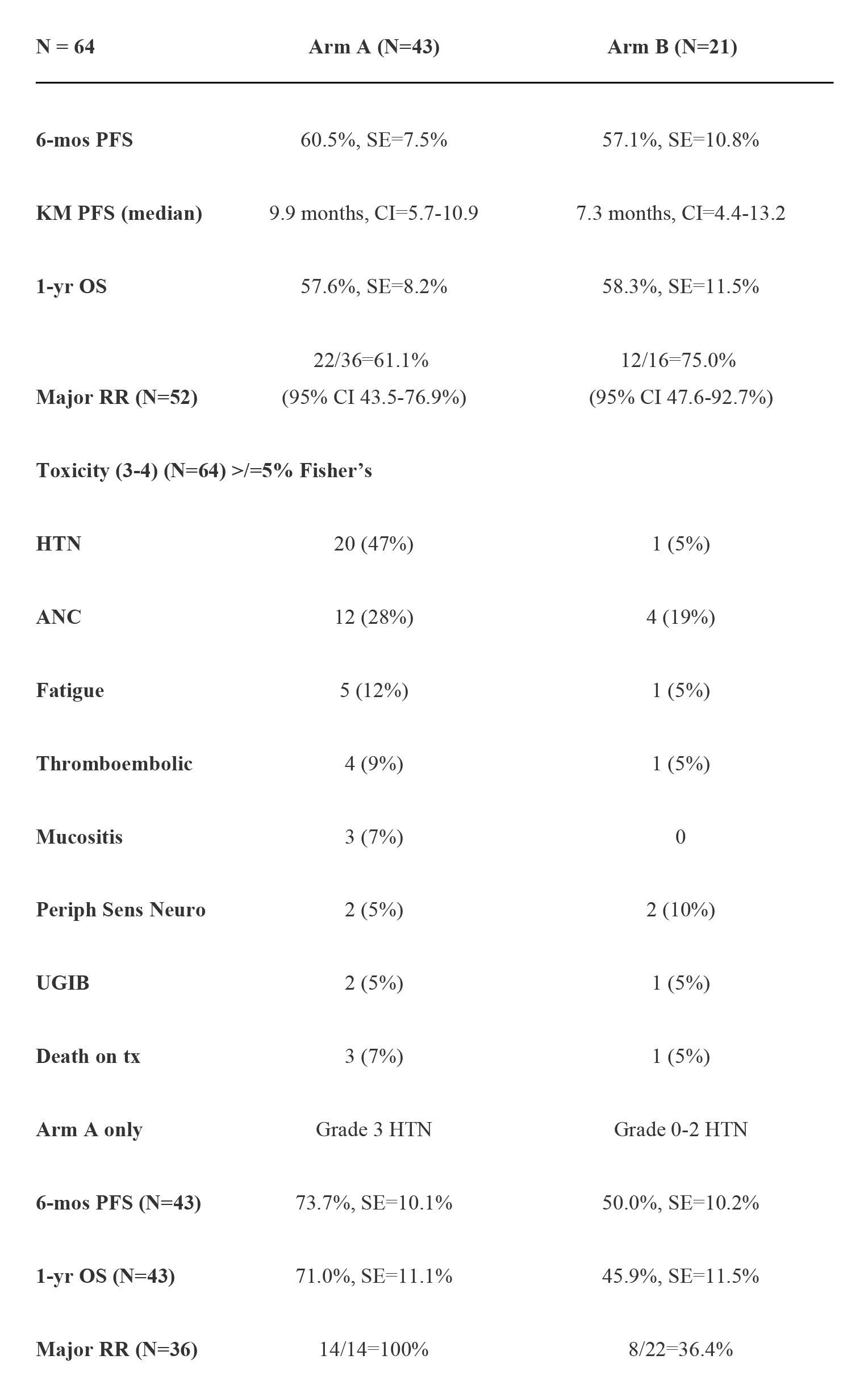
结论:zv-aflibercept没有显著改善FOLFOX的功效。高血压可预测患者对zv-aflibercept的反应。除了高血压外,两组组之间的毒性反应没有显著差异。
(临床试验编号:NCT01747551)
T-DM1(曲妥珠单抗DM1共轭物)在晚期胃癌/胃食管结合部腺癌患者中疗效并不优于紫杉烷
摘要5:一项评估曲妥珠单抗emtansine(T-DM1)与紫杉烷治疗以前接受过治疗的HER2阳性的局部晚期或转移性胃癌/胃食管结合部腺癌患者的随机、开放、多中心II/III期研究。
背景:曲妥珠单抗(H)+卡培他滨/氟尿嘧啶+顺铂HER2阳性转移性胃癌/胃食管结合部腺癌(MGC / GEJC)的标准一线治疗,但目前还没有明确的靶向HER2二线治疗方案。T-DM1(曲妥珠单抗DM1共轭物)被批准用于以前接受过曲妥珠单抗+紫杉烷(单独或组合)治疗的HER2阳性转移性乳腺癌患者。临床前研究HER2阳性胃癌模型为GATSBY(NCT01641939)研究提供了一定理论依据。
方法:GATSBY是一项评估曲妥珠单抗emtansine(T-DM1)vs紫杉烷治疗一线氟尿嘧啶+铂±HER2靶向治疗后进展的HER2阳性(免疫组织化学[IHC] 3+或IHC 2 + /原位杂交阳性)不可切除的LA / MGC / GEJC患者的随机、开放、多中心II/III期研究。患者按2:2:1比例随机分配至T-DM1 3.6 mg/kg,每3周(Q3W),T-DM1 2.4 mg/kg每周(qw)以及紫杉醇80 mg/m2 QW或多西他赛75 mg/m2 q3w。独立数据监察委员会选定T-DM1 QW组进行进一步研究,随后患者按2:1随机配至T-DM1 QW组或紫杉烷组。主要终点是总生存(OS),所有T-DM1 QW数据,包括剂量选择都进行分析。
结果:临床截止时间2015年6月30日之前,共入组415例患者,其中T-DM1 QW 228例,紫杉烷组117例(T-DM1 Q3W组70例另外报告)。77.4%的患者之前接受过HER2靶向治疗,29.9%患者以前接受过胃大部切除术; 46.1%为亚裔患者。功效/安全性如下表。
.png)
结论:T-DM1 2.4 mg/kg QW的疗效并不优于紫杉烷。 T-DM1的≥3级毒副反应率低于紫杉烷组,两者之间的严重不良事件、致命性不良事件以及由于不良反应终止治疗发生率相似。
(临床试验编号:NCT01641939)
Nivolumab单药治疗晚期或转移性GC / GEC患者有效性和安全性良好
CheckMate-032研究结果:nivolumab单一疗法治疗晚期和转移性(A / M) 胃或胃食管交界处癌(GC / GEC)患者的疗效和安全性
背景:晚期和转移性(A / M) 胃或胃食管交界处癌(GC / GEC)患者的预后很差,1年生存率<30%,且治疗方案有限。 Nivolumab是一种完全人抗PD-1的IgG4单克隆抗体,在黑色素瘤、非小细胞肺癌和肾细胞癌中疗效和安全性良好。CheckMate-032是一项研究评估nivolumab±ipilimumab在实体肿瘤中运用的I / II期开放性研究。本摘要报告的是nivolumab单药治疗GEC / GC的初步研究结果。
方法:病理证实晚期或转移性GC / GEC的患者,不论PD-L1的状态,分别接受nivolumab单独(3 mg/kg IV Q2W)治疗直到病情进展(PD)或出现无法忍受的毒性。主要终点是客观缓解率(ORR),其他终点包括安全性、无进展生存期、总生存期(OS)以及生物标志物的状态。
结果:共入组59例患者,予单药nivolumab处理。平均年龄为60岁(范围29-80)。83%的患者既往接受≥2种治疗方案。研究截止时间时,10例患者仍在积极治疗中,49例患者停药(其中PD,N = 40;不相关不良事件,n = 4;治疗相关的不良事件[TRAEs],N = 2;其他,N = 3)。患者平均接受4次剂量(范围1-25)的nivolumab处理。ORR为12%(N = 7/58; 1完全缓解,6例部分缓解); 12例(21%)病情稳定。在这部分患者中,反应的持续时间平均为7.1个月(95%CI,3.0-13.2)。中位OS为6.8个月(95%CI,3.3-12.4); 12个月OS率为38%(95%CI,23.2-52.7)。39%的患者PD-L1表达阳性,PD-L1表达阳性和阴性患者的ORRs分别为18%和12%。66%的患者发生TRAEs,大多数是1/2级。 3/4级TRAEs发生率14%,包括肺炎、疲劳、腹泻、呕吐、甲状腺功能减退和天冬氨酸和丙氨酸氨基转移酶和碱性磷酸酶水平升高。无治疗相关死亡发生。
结论:Nivolumab单药治疗的耐受性良好,在既往接受过治疗的晚期或转移性GC / GEC患者中表现出较好的抗肿瘤活性。肿瘤PD-L1表达阳性和阴性患者中均出现了客观缓解。
(临床试验信息:NCT01928394)
PD-LI抗体Pembro在PD-L1 +晚期食管癌患者中毒性可控且抗肿瘤活性良好
KEYNOTE-028研究(MK-3475): pembrolizumab用于晚期食管癌患者的 Ib期研究更新结果
背景:PD-L1和PD-L2的表达与食管癌的预后差相关。 Pembrolizumab(pembro)是抗PD-1的人源化单克隆抗体,与PD-L1和PD-L2具有相互作用。多队列,主旨KEYNOTE-028(NCT02054806)是一项评估pembro在PD-L1 +晚期实体肿瘤患者中安全性和有效性的多中心、Ib期临床试验。本研究报告的是这项研究中关于食管癌人群的更新结果。
方法:主要入组标准包括食道或胃食管交界处的腺癌或鳞状细胞癌、肿瘤或基质细胞免疫组化确认PD-L1表达、标准治疗失败以及ECOG PS 0-1。患者接受pembro 10 mg/kg,每2周一次长达2 年或直到病情进展,出现不可耐受反应或研究者决定终止治疗。前6个月每8周进行疾病评估,随后每12周进行一次。主要终点根据RECIST v1.1标准由研究者评估的ORR。结果:共入组23例患者,平均年龄为65岁,82.6%为男性,73.9%为鳞状细胞癌,87.0%的患者因转移性疾病接受≥2次既往治疗。数据截止日期2015年8月4日,中位随访时间为31周(范围5.7-71)。9例(39.1%)患者出现有药物相关不良事件(DRAEs),最常见为食欲下降(N = 3,13.0%)。4例(17.4%)患者出现3级DRAEs, > 1例患者报道过淋巴细胞减少(2例,8.7%)。没有患者由于DRAE死亡或终止pembro治疗。免疫介导的不良事件为2级甲状腺功能减退症(2例,8.7%)和肾上腺皮质功能不全(N = 1,4.3%)。ORR为30.4%(95%CI 13.2-52.9),病情稳定率为13.0%(N = 3,95%CI为2.8-33.6); 6月和12个月PFS率分别为30.4%和21.7%。数据截止时,7例有效患者中,5例仍在继续接受治疗,中位缓解时间 40.0周(范围24.1+到46.1+)。 PD-L1的表达水平和抗肿瘤活性之间的关系正在进行分析中。
结论:Pembro在既往接受过治疗的PD-L1 +晚期食管癌患者中毒性可控且抗肿瘤活性较好, pembro治疗食管癌的II/III期临床试验正在进行中。
(临床试验信息:NCT02054806)





 京公网安备 11010502033352号
京公网安备 11010502033352号